证据:孟山都1990-2009多项两年鼠研究发现肝细胞腺瘤,农业农村部竭力宣扬“无致癌”
网页标题:
证据:孟山都1990-2009多项两年鼠研究发现肝细胞腺瘤,农业农村部竭力宣扬“无致癌”
13、孟山都委托1981年完成的26个月喂养研究发现雄性大鼠发生肝肿瘤结节后、在1993、1996、1997、2001与2009年的两年喂养研究在雄性大鼠中皆发现肝细胞腺瘤,国内外众多研究证实草甘膦损害肝脏及其功能,美国与法国2019年临床研究也确认草甘膦对患者造成肝癌前病变!
三、证据:
1、孟山都环境卫生实验室1990年9月26日出具的《两年SD大鼠中(“草甘膦原药”)两年结合慢性毒性/致癌性研究》中发现“雄性 - 雄鼠肝细胞腺瘤有与剂量相关性略有增加”!
证据01(1991年6月):环保署毒理学分部William Dykstra致注册部Lois Rossi, Robert Taylor备忘录《草甘膦;SD大鼠中两年结合慢性毒性/致癌性研究》确认:
所要求的行动:审查新的两年SD大鼠中两年结合慢性毒性/致癌性研究。
结论与推荐建议:
由于与同时对照组相比,每个接受处理的雄性组中胰岛细胞瘤的发病率较高(2000、8000和20,000 ppm),毒理学第一科建议由同行评审委员会解决草甘膦的致癌性。该问题的大概日期是1991年6月中。
该研究可以作为“核心指导数据”。随附该研究的数据评估报告。
“未观察到影响水平”(NOEL)为8000 ppm的中剂量,“最低影响水平”(LEL)是20,000 ppm的高剂量。在LEL时,其作用包括降低雌性的体重和体重增加,雄性的白内障,降低雄性尿液pH,在12个月时增加相对肝脏重量(相对于身体),以及在24个月时增加绝对和相对肝脏重量(相对于大脑)。
审查者:William Dykstra,博士,毒理学部I处
二次审查者:Roger Gardner,处长,毒理学部I处
数据评估报告
研究类型:83-5 -- 慢性毒理学/致癌性结合试验 - 大鼠
档案号:416438-01(1-6卷)
试验材料:草甘膦原药(Glyphosate, technical);96.5%纯度;批次号XLH-264
别名:Roundup(农达)
研究号:MSL-10495
资助方:孟山都公司
试验设施:孟山都环境卫生实验室
报告标题:饲喂Albino大鼠中服用草甘膦慢性研究
作者:L. D. Stout and F.A. Ruecker
报告出具日期:1990年9月26日
A、材料:
1. 试验化合物 - 草甘膦原药(Glyphosate technical);描述:白色粉末;批次号:XLH-264;纯度:96.5%;
2. 试验动物:品种:Albino大鼠;品系:SD大鼠;年龄:8周;体重:雄性284克,雌性221克;来源:Charles River 繁殖实验室。
......
4,Cecil Moore博士和Lionel Rubin博士在所有动物的预测试期和临终前两次进行眼科检查。
结果-与最终处死对照组相比,在高剂量雄性大鼠组中,Moore博士和Rubin博士均发现白内障和晶状体异常在统计学上显着增加。
... 结果 - 没有化合物相关的临床化学发现或变化被认为具有毒理学意义。大多数具有统计意义的变化很小,并且不一致或与剂量相关。 与对照组相比,高剂量雌性的碱性磷酸酶(alkaline phosphatase)在24个月时有统计学上的显着增加(对照值的187%)。 这是由于雌鼠F3053的值为490 IU / L。 当不计算这只动物时,高剂量组不再具有统计学意义。
F3053的组织病理学结果评估显示以下肿瘤:嗜铬细胞瘤,乳腺腺癌(转移至肺),以及乳腺腺瘤、腺纤维瘤和纤维瘤。其他非肿瘤性病变也存在于肝脏、心脏和肾脏中。......
c. 微观病理学- ...
1)非肿瘤-中剂量雌鼠胃鳞状粘膜发炎发生率有统计学意义的增加。
由于病变与剂量无关,病情严重程度并未随剂量增加,又在大剂量的历史对照范围内,并且仅在两个病例中发生(一只中剂量雌性(F2014)和最终处死一只高剂量雄性(M3002))动物中(注:这意味着在未达到最终处死的大鼠中,该病变共发生了33次),因而该病变不被认为与化合物相关。
2)肿瘤
1. 胰腺-低剂量雄性胰腺胰岛细胞腺瘤的发生率具有统计学意义。
... 从研究结果可以看出,低剂量和高剂量组胰岛细胞腺瘤的发生率超过了历史控制的1.8%至8.5%。 然而,在雄性中这些肿瘤的发生没有任何剂量-反应关系,没有进展为癌,并且增生的发生与剂量没有关系。
2. 甲状腺-C细胞腺瘤在雄性和雌性中剂量,高剂量组中略有增加 ...
由于两性腺瘤均无剂量反应,无以剂量相关的方式发展为癌,在增生的分级或发生的严重性方面也无剂量相关的显着增加,并且根据历史对照腺瘤,雄性和雌性的C-细胞腺瘤未被认为与化合物相关。
肝
雄性 - 雄鼠肝细胞腺瘤有与剂量相关性略有增加,但发病率在孟山都公司环境卫生实验室(EHL)的历史对照范围内。
... 从肝细胞肿瘤数据、历史对照和非肿瘤性肝病灶数据可以看出,没有从腺瘤到癌的进展,非新陈代谢性病变(增生、小叶中心坏死和细胞改变的焦点)未显示出与化合物有关的作用。因此,雄性中肝细胞腺瘤的发生率略有增加被认为与化合物无关。...

William Dykstra. Toxicology Branch.Memo: Glyphosate; 2-Year Combined Chronic Toxicity/ Carcinogenicity Study in Sprague-DawleyRats - List A Pesticide for Reregistration Pages 29-40 removed-registrant data.June 03, 1991.MRID 416438-01. Tox review 008390.
William Dykstra。毒理学分部。备忘录:草甘膦;SD大鼠中两年结合慢性毒性/致癌性研究 - 清单A 申请注册农药,第29-40页,移除注册数据。1991年6月3日。
MRID 416438-01.毒理学审查008390。
https://archive.epa.gov/pesticides/chemicalsearch/chemical/foia/web/pdf/103601/103601-263.pdf
证据02(1991年10月):环保署备忘录:《对草甘膦第二次同行专家审查》确认:
环保署《健康影响部》致癌性同行审查委员会1991年6月26日聚会进行讨论与评价。......
2. Stout, L. D. and Ruecker, F. A. (1990). Chronic Study of glyphosate Administered in Feed to Albino Rats. Laboratory Project No.MSL-10495; Sept. 26, 1990. MRID No416438-01; Historical Controls; MRID No.417287-00.
2. Stout, L. D. and Ruecker, F. A. (1990). 在饲料中给Albino鼠服用草甘膦慢性研究。实验室项目第MSL-10495号;1990年9月26日。MRID No416438-01;历史对照;MRID No.417287-00.
a. 实验设计
在饮食中以浓度分别为1000、5000或30,000 ppm的草甘膦,对50只雄性和50只雌性CD-1小鼠分组,持续18个月。......
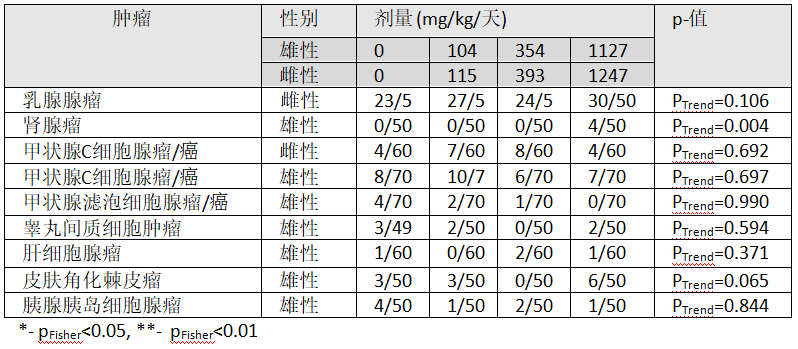
iii. 肝(表7:草甘膦-Sprague-Dawley雄性大鼠,肝细胞肿瘤率,Cochran抑制趋势和Fisher精确测试结果[p值])
雄性肝细胞腺瘤的剂量相关性略有增加,但发病率在孟山都公司环境卫生实验室(EHL)的历史对照范围内。 报道的肝细胞癌历史对照发生率在0%至6.7%之间,肝细胞腺瘤的历史对照发生率在1.4%至18.3%之间。其他肝细胞病变的发生率没有剂量相关的增加。
委员会的解释:尽管雄性肝细胞腺瘤的剂量相关性略有增加,但与对照组的成对比较,这种增加并不明显,并且在历史控制范围内。 此外,没有从腺瘤到癌的进展,增生的发生与化合物无关。因此,雄性中肝细胞腺瘤的发生率略有增加,这被认为与化合物无关。......
F、证据的权重考虑......
3. 雄性大鼠肝细胞腺瘤的剂量相关性略有增加(表7),但发病率在孟山都公司环境卫生实验室(EHL)的历史对照范围内。与对照组的成对比较中,这种增加并不显着,并且没有从腺瘤到癌的进展。增生的发生与化合物无关。其他肝细胞病变的发生也没有相关的增加。因此,雄性中触觉细胞腺瘤发生率的增加被认为与化合物无关。......
EPA Memo Second Peer Review of Glyphosate, 1991-10-30
环保署备忘录:对草甘膦第二次同行专家审查,1991-10-30
http://www.epa.gov/opp00001/chem_search/cleared_reviews/csr_PC-103601_30-Oct-91_265.pdf
2、美国疾病控制与预防中心(CDC)的国家环境卫生中心(NCEH)前主任,同时任有毒物质和疾病登记局(ATSDR)前主任确认孟山都委托1981年完成的26个月喂养研究发现雄性大鼠发生肝肿瘤结节后、在1993年、1996年、1997年、2001年与2009年的两年喂养研究在雄性大鼠中皆发现肝细胞腺瘤。
证据03(2017年10月):美国草甘膦除草剂致淋巴癌诉讼证词:Christopher J. Portier博士对于草甘膦除草剂致癌性向法庭提交的《专家意见》(案件3:16-md-02741-VC 文件654-17,注册日期:2017年10月28日,共97页)
资质
我于1977年从(路易斯安那州)尼科尔斯州立大学(Nicholls State University)获得了数学学士学位,并在北卡罗来纳大学公共卫生学院分别于1979年和1981年获得生物统计学硕士学位与博士学位。我的博士学位论文探讨了设计一项为期两年的啮齿类动物致癌性研究的最佳方法,以评估一种化学品引起癌症的能力[1,2]。 大多数研究人员仍使用我论文中的最佳剂量模式。
我获得博士学位后的第一份工作是在美国环境健康科学研究所(NIEHS)和美国国家毒理学计划(NTP)的联合任命下,进行毒理学中通常使用的实验的设计和分析研究。
在NIEHS / NTP工作的32年中,我参与了我个人研究活动之外的许多国家优先事项。... 在NIEHS / NTP期间,我还担任与我的资格相关的行政职务。从2000年到2006年,我担任NIEHS的环境毒理学计划(ETP)主任。
我于2010年离开NIEHS/NTP,出任美国疾病控制与预防中心(CDC)的国家环境卫生中心(NCEH)的主任,同时担任有毒物质和疾病登记局(ATSDR)的主任。 NCEH进行研究并支持旨在减少环境危害对公共卫生的影响的活动。NCEH的一项备受推崇的研究工作是国家生物监测计划。该程序测试在美国全国人群中人体血液和尿液中是否存在数百种化学物质。
除了我在联邦工作中的职务外,我还担任过许多国家和国际科学咨询小组的成员。就本声明的资格而言,最值得注意的是,2005年至2010年期间我担任总统国家科学技术委员会毒理和风险小组委员会的主席,1998年至2003年期间担任美国环保署(EPA)科学顾问小组的成员和主席(特别关注关于为农药计划提供咨询的建议),同时担任国际癌症研究机构(IARC)咨询小组主席,该小组更新并改进了其审查科学数据的规则,以确保关于人体暴露致癌性的结论是最佳的(序言)[30]。...
我发表过250多篇关于毒理学与风险评估方面经同行审查的论文、专著章节与技术文件。...
我为美国环保署(EPA),美国食品和药物管理局(FDA),美国疾病控制与预防中心(CDC),国立卫生研究院(NIH),世界卫生组织(WHO)和国际癌症研究机构(IARC)的风险评估做出了贡献。
信赖清单
在准备本报告的过程中,我查看了以下材料:
a. 所有有关草甘膦制剂引起人类非霍金斯淋巴瘤(NHL)能力的流行病学数据。
b. 关于非霍金斯淋巴瘤(NHL)细胞起源的科学论文
c. 与草甘膦引起的致癌性,遗传毒性和氧化应激有关的同行评审科学数据
d. 被告向原告律师提供的有关草甘膦致癌性的技术报告
e.美国环保署(EPA)、欧洲食品安全机构(EFSA)、德国联邦风险评估研究所、欧洲化学机构、国际癌症研究机构(IARC)和世卫组织(WHO)/粮农组织(FAO)农药残留联席会议对与农药残留有关的科学文献审查草甘膦可能致癌的文件。
f. 欧洲食品安全机构(EFSA)提供的有关被告以外的组织准备的有关草甘膦的动物致癌性数据的技术文件
g. 诉讼中产生的其他各种文件
本报告结尾列出我依赖的文件的完整清单。......
表1:Lankas (1981)[74]26个月喂养研究雄性与雌性SD大鼠中令人关注的肿瘤
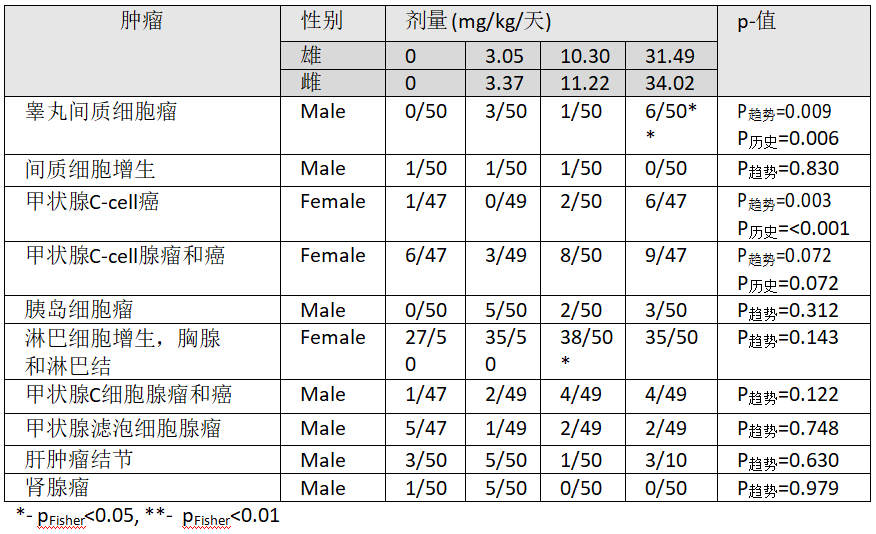
总之,本研究显示雄性SD大鼠睾丸间质细胞瘤和肝细胞腺瘤的阳性结果,以及雌性SD大鼠甲状腺c细胞癌的阳性反应,将纳入对(草甘膦-致癌)因果关系的整体评估。
Stout and Ruecker (1990)[78]研究中,50只SD雄鼠与50只SD雌鼠接触于饲料中草甘膦24个月(具体剂量间表2)。这项研究依照OECD(经济合作与发展组织)指导原则进行。
该研究中没观察到存活差别,也没有表明使用的最高剂量超过了最高容忍剂量。
在所有剂量组中,相对于雄性大鼠对照组,胰岛细胞肿瘤增加,并且对于最低(pFisher = 0.015)和最高(pFisher = 0.032)剂量组(表2)统计学显着。但是,这些比率包括一年中处死的10只动物。在一年内终止的大鼠,由于接触时间短,可能没有发生这种肿瘤的风险;将一年处死的这些动物包括在最终肿瘤计数中是非常罕见的(EPA [61]也排除了这些动物)。在本研究的病理学表中,在临时处死的10只动物中没有任何肿瘤。去除这10只动物不会改变趋势或Fisher精确检验的p值。该实验室中该肿瘤的历史对照数据报告为23/432或5.3%[96],与该控制率的趋势比较并不显著(p历史t = 0.15)。这种趋势的缺乏由回应的上下性质驱动。假设5.3%的历史比率正确,那么在47只动物中发现8个或更多肿瘤的概率是0.003。与此类似,对于中剂量和高剂量,这个概率分别为0.124和0.014。雌性没有表现出这种肿瘤增加。作者提供了一个表,其中包含自该研究的胰岛 - 细胞腺瘤和癌的以及来自Lankas等人(1981)[74]研究的肿瘤计数合并结果,作者们争辩认为这样的结果不显示与剂量相关的增加。喂养26个月研究的动物与喂养24个月研究的动物对相同化学物质和非常不同的对照发病率可能具有非常不同的反应。
在雄性大鼠中,除去中期处死的动物后,肝细胞腺瘤有统计学显著性趋势(p趋势= 0.015),腺瘤和癌合并有显著增加(p趋势 = 0.05,表2),但雌鼠没显示(未显示)。 肝癌通常也在单独的分析中提供,但这些数据不是作者提供的(数据表明肝细胞癌将具有负面趋势)。
无论是否包括临时处死动物(表2),雌性大鼠甲状腺C细胞腺瘤也显着增加(p趋势 = 0.049),而且腺瘤和癌合在一起未边际增加6(p趋势 = 0.052)。 在雄性中,腺瘤趋势为p趋势 = 0.084,对于腺瘤和癌一起p趋势 = 0.091。 在中期处死雄性大鼠中观察到腺瘤,表明中期处死雄性大鼠时处于该肿瘤风险中。如果将这些动物重新添加到分析中,则雄性趋势测试对于腺瘤为p趋势 = 0.063,对于腺瘤和癌合并在一起为p趋势 = 0.068。
其他SD鼠喂养研究中显示显著的其他几种肿瘤也包括在表2中,它们在本研究中没有显示显著作用。
作为结论,这项研究中发现胰岛细胞瘤发病率增加,不能作为偶然发现轻易排除。 发现雄性大鼠肝腺瘤显著增加而癌未增加的结果到可能是偶然的。应该将雄性和雌性鼠甲状腺c细胞肿瘤显著增加的发现与其他研究进行比较。 这项研究将被纳入因果关系整体评估中。
表2:Stout and Ruecker (1990)[78]24个月喂养研究中雄性与雌性SD大鼠中令人关注的肿瘤。

Atinson et al. (1993)[68] 对草甘膦(98.9%纯度)进行了一项慢性毒性/致癌性结合在一起的研究。他们在两种性别各自使用了50只SD大鼠,表3中列出其饮食接触剂量。还包括额外35只大鼠/性别/剂量做中间期处死。
该项研究中没有存活差异,也未表明使用的最高剂量超过最高容忍剂量。
表3:Atkinson et al. (1993)[68]SD大鼠24个月喂养研究中引人关注的肿瘤
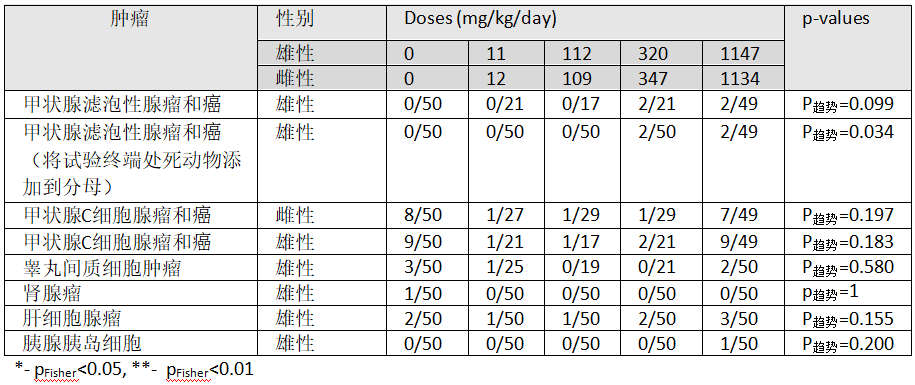
研究作者报告没有显著影响,EPA(美国环保署)[61]与EFSA(欧洲食品安全机构)[89]也如此报告。该研究没有所有组所有动物对每种肿瘤类型进行详细组织病理学检查,但是检查了所有对照组和高剂量动物,而且坚持了研究终止前死亡的所有动物和在研究终止时显示肉眼可见肿瘤的动物;还检查了所有动物的肝、肾和肺。 这严重削弱了该项研究对剂量反应趋势的研究。 然而,在回顾Greim et al.(2015)提供的病理学表格时[91],通过趋势检测发现甲状腺滤泡性腺瘤和癌有轻微显著性(p趋势= 0.099)。 如果三个中间暴露组没有看到其他肿瘤,并且分母是整个50只动物研究,趋势分析变得显着(p趋势= 0.034)。
对研究结束处死的没有大肿瘤动物进行病理检查情况下,这项研究的发现对因果关系整体评价只能给予较小权重。
Brammer (2001)[69]在Wistar鼠中进行了两年致癌性研究,每组52只动物接触草甘膦(97.6%纯度),表4列出各组剂量。额外12只动物在一年时处死。
EPA(美国环保署)指出生存率中显著阳性趋势(p=0.03),然而这样的趋势不是使用Kaplan-Meir测试[97](本应当使用的合适试验)实现的,而是简单相对与研究结束时处死动物的百分百。没有表明使用的最高剂量超过了最高容忍剂量。
EPA(美国环保署)[61],而非EFSA[89],指出与对照组比较雄鼠最高剂量组中肝细胞腺瘤有统计显著趋势。趋势分析给出p趋势=0.008,与此相比,Fisher的研究中高剂量组相对于对照组的相同测试结果为p趋势=0.027。美国环保署驳回了这一发现,可能是由于本研究与对照组的终末处死动物数量略有不同。然而,没有提供正式的生存统计评估,也不能从这些数据中推测这些动物中生存率显著受到影响。Greim et al.(2015)[91]对这种肿瘤使用了略微不同的数字,因为中期处死组中的三只动物(对照组中一个,低剂量组中一个和中剂量组中一个)在其中间处死时间之前就死亡了,从他们论文中提供的病理学表格中可以看出,它们不能与其他病例分开。这些数字被列入表4,而且并未改变研究结果的显著性。 Greim et al.(2015)[91]的研究排除了这些发现,部分原因与EPA(美国环保署)使用的生存论点相同,部分原因是他们有一个历史对照数据集,其历史响应范围为0-11.5%;他们没有提供这些历史对照的平均反应或个体肿瘤反应数据。如前所述,因为某些数据处于历史对照范围内而忽略结果是一种使用历史对照来评估研究的不可接受的方法,在这项研究情况下,没有理由对所使用的对照提出质疑。
表4:Brammer(2001)Wistar鼠24个月喂养研究中雄鼠与雌鼠令人关注的肿瘤
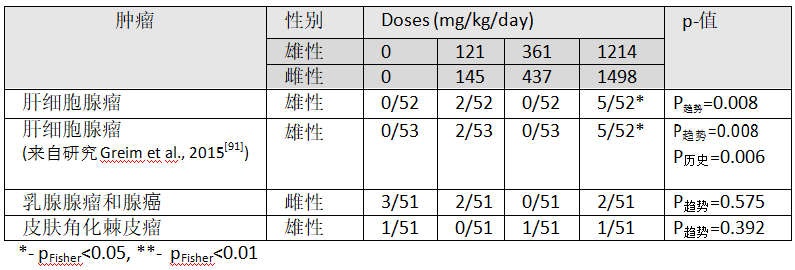
我获得了Charles River实验室2003年至2011年16组Wistar鼠历史性对照[98]。虽然它们超出了Brammer(2001)研究中所用动物的最佳时间范围,但它们可以说明为什么使用范围可能会产生误导。在1217只对照动物中观察到52个肝腺瘤,平均反应为4.27%,范围为0%至17.5%(个体研究结果为6/100,0/60、1/60、1/50、1/80、14/112、1/65、0/60、21/120、0/50、1/50、2/60、0/50、1/100、1/150、2/50;13个研究%响应≤2的)。假设对照组患肿瘤的潜在可能性为4.27%,p历史 = 0.006(表4)。 因此,尽管Brammer(2001)中看到的反应在历史控制范围内,但当适当使用历史控制时,这种趋势非常显著。Greim et al.(2015)也提到了在高剂量时毒性增加的发现,但他们仅提供了对于肝细胞脂肪空泡化和肝炎的数据;对任何测试这些发现均无统计学意义。
总之,这项研究显示了雄性Wistar大鼠肝细胞腺瘤的阳性结果,这项研究将纳入对因果关系的总体评估。
Suresh, (1996)[79]让Wistar鼠接触喂养中草甘膦(96.8%纯度)两年。表5中列出50只动物/性别在四组中试验的情况。
这项研究中没有生存差别,而且所使用的最高剂量没有表明超过最大容忍剂量。
EPA(美国环保署)[65]对这项研究结论没有肿瘤由于接触草甘膦增加,EFSA(欧洲食品安全机构)[89]的结论为,“任何显著显微观察的改变、发生率增加或减少(肝、脾、淋巴结、肾上腺、胸腺、性腺、子宫、乳腺中)被观察到表明剂量关系,因而看来是事故性而并非与试验成分出来相关”(第491页)。
表5: Suresh (1996)[79]的24个月喂养研究中雄性与雌性Wister鼠中引人关注的肿瘤
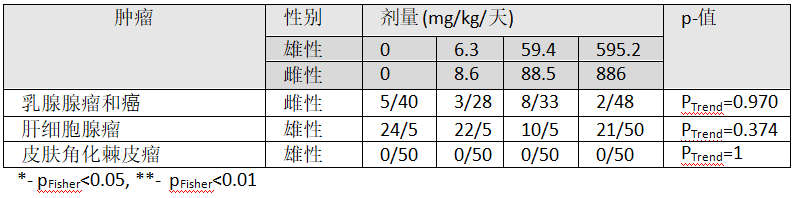
Enemoto (1997)[72]的研究中让SD大鼠接触喂养中草甘膦(95.7%纯度)两年。对四个接触组中50只动物/性别进行测试(参看表6)。此外,每个接触组10只鼠接触草甘膦1年,另外10只鼠接触18个月然后处死检查。这些组中中期处死动物(1年与18个月)如果看到肿瘤就也包括在分析中。
这项研究中没有生存差别,而且最高剂量不现实超过最高容忍剂量。
EPA(美国环保署)与EFSA(欧洲食品安全机构)在任何组中都没有发现肿瘤中显著改变。Greim et al. (2015) 再次提供了肿瘤数量表,除了雄鼠中肾腺瘤发生率(p趋势=0.004,表6)外,未显示任何其他显著效应。
对Greim et al. (2015) 提供的病理学检查表的审查,未揭示肿瘤发生率随剂量增加的任何其他肿瘤。对SD鼠进行的另外一项研究[74],显示乳腺腺瘤、甲状腺C细胞癌、皮肤角化棘皮瘤和睾丸间质细胞瘤强烈显著趋势,因此这些数据也包括在表6中进行比较。
这项研究显示肾腺瘤中显著增加,将包括在因果关系整体评估中。
表6:Enemoto (1997)[72]的24个月喂养研究中雄性与雌性SD鼠中引人关注的肿瘤
Wood et al. (2009)[80]研究中让Wistar鼠接触饲料中草甘膦(94.7%-97.6%纯度)两年。在四个接触组中对五十一只动物/性别进行试验,剂量在表7中列出。
EFSA(欧洲食品安全机构)[89]未发现随剂量增加的肿瘤,但是EPA(美国环保署)指出乳腺腺瘤和腺癌结合在一起增加而且对腺瘤p趋势=0.062,对腺癌p趋势=0.042,而对肿瘤结合在一起p趋势=0.007(表7)。EPA结论,没有腺瘤到腺癌的进展并争辩说观察到的增加非草甘膦相关。这样的结论与对照组和低剂量组中6只动物发生腺癌但是这两组中没有任何动物发生腺瘤的事实矛盾。这看来,在这种情况下,乳腺腺癌可以在不存在任何腺瘤情况下发生。
Greim et al (2015)[91]也指出雄鼠中皮肤角化棘皮瘤增加(p趋势=0.030)。对病理学表的审查没有发现任何肿瘤随剂量增加。另外一项研究发现Wistar鼠[69]中肝细胞腺瘤中强烈显著趋势,所以这种肿瘤也包括在表7中比较。
这些研究显示雌鼠中乳腺肿瘤与雄鼠中皮肤角化棘皮瘤增加,将在因果关系评价中使用。
表7:Wood et al. (2009)[80]的研究中Wistar鼠24个月喂养研究雄鼠与雌鼠中引人关注的肿瘤

联合分析
表8总结对老鼠研究中引入关注所有肿瘤的显著性。Brammer(2001)[69]观察到随着剂量增加,雄性Wistar大鼠的肝细胞腺瘤显着增加(p趋势= 0.008,表4)。 Wistar大鼠中另外两项可接受的研究(Wood等人(2009)[80]和Suresh(1996)[79])没有显著增加(表5和表7)。根据统计学显著性,这些研究相互之间不一致。
如同在硬币三次翻转中结果是一个正面和两个反面来拒绝不公平那样,仅凭1/3阳性就拒绝研究的发现也不公平,而且有更好的方式来解决这些发现。鉴于不同的剂量和不同的样本量,我们需要正式测试这些研究的一致性。
Suresh(1996)在对照组中观察到48%的肝细胞腺瘤反应,而另外两项研究在对照动物中没有看到肿瘤。因此,虽然所有三项研究都是Wistar大鼠中研究,但Suresh(1996)与另外两项研究的对照反应显著不同。 Suresh(1996)没给出使用了Wistar大鼠何种亚种,但Brammer(2001)和Wood等人(2009年)使用了Wistar大鼠不同的亚种。三项研究使用不同的饮食,并在不同的设施进行。因此,对Suresh(1996)的显著不同比率没有明显的解释。已知来自不同实验室的同品种大鼠可能具有显著不同的对照肿瘤响应。由于他们有类似的对照响应,可以将Brammer(2001)和Wood等人(2009年)的研究汇集到一项研究提出这样的问题:“将Brammer(2001)的研究与Wood等人(2009)的负面研究汇合在一起进行研究时,Brammer(2001)的显著趋势是否会消失?”对合并研究的分析得出p趋势 = 0.013,这支持了草甘膦导致具有类似背景响应的Wistar大鼠肝细胞腺瘤的结论。
Wood et al. (2009)[80] 的研究见到其他两项研究(表4与表5)中没有看见的雌鼠中乳腺腺瘤和腺癌显著增加(p趋势=0.007,表7)。这些研究中的背景发生率仅稍微不同,而且对所有三项研究在一起的汇总分析得到p趋势A=0.459,提议将这些数据结合在一起排除了Wood et al. (2009)研究中看到的剂量-响应趋势。然而,如果Suresh (1996)研究中食用的Wistar鼠对肝细胞腺瘤的响应有所不同,它们对这种肿瘤的响应可能也有所不同。仅将Wood et al. (2009) 研究与 Brammer (2001)研究结合在一起的结果为 p趋势=0.037。考虑到汇总对这种肿瘤在一起的结果,我得出的结论是它们对草甘膦可能导致Wistar大鼠乳腺腺瘤和腺癌的观点支持有限。
Wood et al. (2009)[80]的研究看到另外两项研究(表4与表6)中没有见到的皮肤角化棘皮瘤显著增加(p趋势=0.030,表7)。这些研究中的背景发生率仅稍微不同,而且对所有三项研究在一起的汇总分析得到p趋势A=0.010,提议将这些研究数据汇总在一起不排除Wood et al. (2009)的研究中见到的剂量-响应趋势。仅将Wood et al. (2009)研究与 Brammer (2001)研究结合在一起的结果为 p趋势=0.053。考虑到汇总对这种肿瘤在一起的结果,我得出的结论是它们支持草甘膦可能导致Wistar大鼠皮肤角化棘皮瘤的观点。
在SD大鼠中,有四项研究被纳入评估因果关系,其中一项[74]对雌鼠甲状腺C细胞癌与对雄鼠睾丸间质肿瘤和肝细胞腺瘤获得强烈阳性响应,其他一项[72]对雄鼠肾腺瘤产生强烈的结果。Lankas (1981)[74]的研究看到暴露于草甘膦雌鼠中甲状腺C细胞癌显著增加(p趋势=0.003,表1)以及C细胞腺瘤和癌综合分析时略微增加(p趋势=0.072, p历史=0.072,表1);其余三项研究中的一个也见到雌鼠中甲状腺C细胞腺瘤和癌略微增加(表2)。使用所有四项研究数据综合分析得到p趋势A=0.390。这样的综合分析不支持Lankas (1981)研究中看到的结果。然而,Lankas (1981)的研究为26个月,而其他三项研究为24个月;C细胞癌可能是更长暴露时间的结果,尽管研究中的剂量显著低于其他两项研究的剂量。从这些数据,我结论,草甘膦在雌性SD鼠中造成甲状腺C细胞肿瘤的证据较弱。
甲状腺C细胞腺瘤和癌结合在一起,在Stout and Ruecker(1990,表2)的研究显示边际显著剂量-响应趋势,但是其余三项研究没见到这样的趋势。将四项研究一起综合分析得到显著趋势p趋势A=0.041。从这些数据,我结论有证据表明草甘膦在雄性SD鼠中造成甲状腺C细胞肿瘤。
甲状腺滤泡细胞腺瘤和癌结合在一起,在Atkinson et al. (1993,表3)的研究显示显著剂量-响应趋势,但是其余三项研究未见这样的趋势。将四项研究一起综合分析得到显著趋势p趋势A=0.618。从这些数据,我结论没有证据表明草甘膦在雄性SD鼠中造成甲状腺滤泡细胞腺瘤。
在Stout and Ruecker (1990)的研究在雄鼠中显示肝细胞腺瘤有显著剂量-响应趋势(表2),但是其余三项研究未显示。将所有四项研究综合分析得到边际显著趋势p趋势=0.073。从这些数据,我结论有限证据表明草甘膦在雄性SD鼠中造成甲状腺滤泡细胞腺瘤。
表8:老鼠中7项研究对5种肿瘤显著测试总结
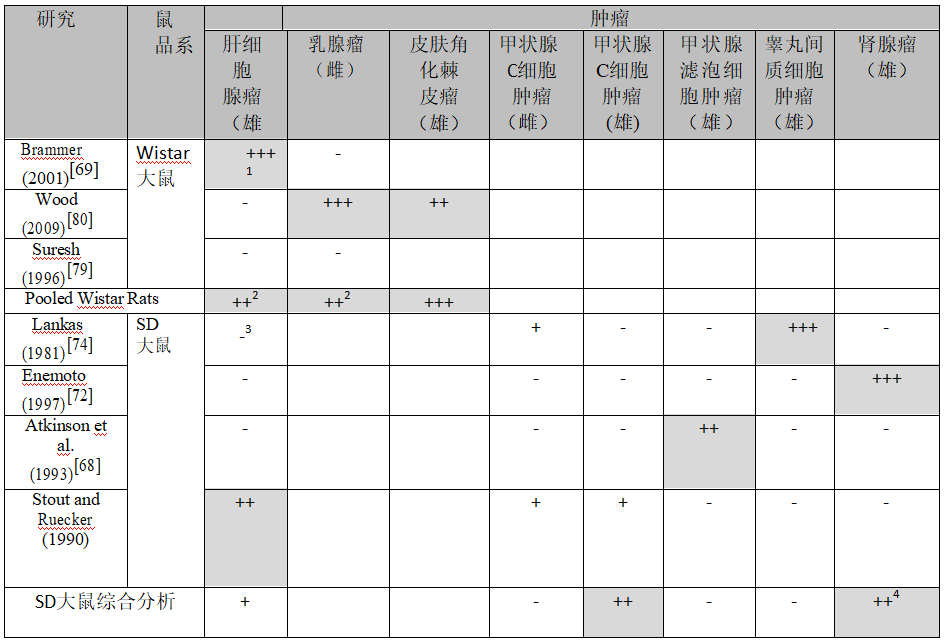
1输入值为带值的p趋势/p历史: – p>0.1, + 0.1≥p>0.05, ++ 0.05≥p>0.01, +++ p≤0.01;2仅Brammer (2001) 研究与 Wood (2009) 研究的综合分析结果;3肝肿瘤结节;4不包括Lankas (1981)研究。
SD大鼠中见到的另外一个显著趋势是Lankas(1981)[74]研究中发现的睾丸间质细胞瘤(P趋势=0.009,表1);其余三项研究对这种肿瘤阴性(表2、表3与表6)。将其余三项研究与Lankas(1981)研究结合在一起对睾丸间质细胞瘤的趋势综合分析得到的p值为清楚不显著(p趋势A=0.608)。然而,如上边注明的那样,Lankas(1981)研究是26个月研究而另外两项研究为24个月研究;这样的肿瘤可能是更长暴露期间的结果,尽管Lankas(1981)研究中使用的剂量显著低于StoutandRuecker(1990)、Atkinsonetal.(1993)与Enemoto(1997)研究中使用的剂量。
从Enemoto(1997)[72]的研究,SD大鼠中表明一种强烈显著趋势的最终肿瘤为雄鼠肾腺瘤(P趋势=0.004,表6)。Lankas(1981)[74](表1)、Atkinsonetal.(1993)[99](表3)与StoutandRuecker(1990)[78](表2)的研究中肾肿瘤数据不显著。将Enemoto(1997)的研究与Lankas(1981)[74]、StoutandRuecker(1990)和Atkinsonetal.(1993)的研究数据综合分析得到p趋势A=0.201。去除26个月的Lankas(1981)[74]研究后,其余三项24个月的研究的p值为p趋势=0.031;因此,草甘膦与肾腺瘤关联得到这些数据的支持,甚至Atkinsonetal.(1993)的研究低剂量与中剂量组结果难于解释的关联也支持这样的关联。
有证据支持暴露草甘膦增加雄性SD鼠中肾肿瘤。
总之,有证据表明草甘膦在雄性Wistar大鼠中造成肝细胞腺瘤和皮肤角化棘皮瘤,在雌性Wastar大鼠中造成乳腺腺瘤和腺癌,以及在雄性SD大鼠中造成肾腺瘤和甲状腺C细胞腺瘤和癌。有有限证据表明草甘膦在雄性SD鼠中造成肝细胞腺瘤。
......
![]()

Dr.ChristopherJ.Portier(克里斯托夫 J. 帕特尔博士)
引用参考文献:(略)
Christopher J. Portier, PhD, Expert Opinion on Carcinogenicity of Glyphosate/Roundup presented to court(Case 3:16-md-02741-VC Document 654-17 Filed 10/28/17, total 97 pages)
https://usrtk.org/wp-content/uploads/2017/10/Chris-Portier-expert-report.pdf
3、尼日利亚1979年研究揭示“草甘膦提高了从大鼠肝脏分离的线粒体的耗氧率”后、芬兰、阿根廷、巴西、英国、法国、意大利、美国、加拿大、克罗地亚、墨西哥学者多项研究揭示草甘膦除草剂残留损害动物与人类肝脏及其功能
3-1 《环境污染与毒理学通报》1979年6月发表尼日利亚Ibadan大学生物化学系学者研究确认:“已表明,伴随草甘膦中毒的症状包括直肠温度升高、窒息性抽搐和严重僵死”、“该项研究提出的结果表明,当反应介质缺乏磷酸盐受体时,单次腹膜内给药草甘膦5小时后,草甘膦提高了从大鼠肝脏分离的线粒体的耗氧率。”
证据04(1979年6月):《环境污染与毒理学通报》(Bulletin of Environmental Contamination and Toxicology)发表尼日利亚Ibadan大学生物化学系Olufunso Oet al.《草甘膦对体内大鼠肝线粒体的影响》确认:
业已表明,伴随草甘膦中毒的症状包括直肠温度升高、窒息性抽搐和严重僵死(OLORUNSOGO 1976)。 鉴于这些迹象也是由许多化合物引起的,干扰与线粒体中的能量代谢过程有关(DIECHMANN et ai, 1942, PIESS and FIELD 1948, BUFA et ai. 1963, PARKER 1965),尝试研究草甘膦对肝脏线粒体能量守恒过程的体内作用。
该项研究提出的结果表明,当反应介质缺乏磷酸盐受体时,单次腹膜内给药草甘膦5小时后,草甘膦提高了从大鼠肝脏分离的线粒体的耗氧率。这些线粒体的呼吸控制率也降低了。在60 mg / kg时,该参数至少降低了40%。氧化磷酸化的部分反应被认为是偶联机理的可逆性和多步性质的反映。
氧化磷酸化的重要部分反应是腺苷三磷酸酶(ATPase)活性,该活性通常由二硝基苯酚和其他解偶联剂刺激。
由于草甘膦对无ADP呼吸的增强作用及其对从草甘膦中毒大鼠肝脏获得的线粒体的ADP刺激呼吸的抑制作用,因此研究了除草剂对ATPase活性的影响。
呈现的结果表明,用除草剂处理过的动物的肝脏中ATPase活性增强。在草甘膦中毒的动物的肝线粒体中,常见的两个或三个位点底物的脱氢酶活性也略有增强。这些发现表明线粒体氧化磷酸化的解偶联可能是草甘膦中毒的主要病灶。
Olufunso Oet al., Effect of glyphosate on rat liver mitochondriain vivo, Bulletin of Environmental Contamination and Toxicology, 1979 Jun;22(3):357-64.
Olufunso Oet al.,草甘膦对体内大鼠肝线粒体的影响。
环境污染与毒理学通报。1979年6月;22(3):357-64.
https://link.springer.com/article/10.1007/BF02026955
3-2 芬兰生理系、职业卫生学者1983年研究揭示:“草甘膦降低了肝细胞色素P-450的含量和单加氧酶的活性,降低了芳烃羟化酶的肠道活性。草甘膦...似乎抑制了单加氧酶。”
证据05(1983年2月):《药理学毒理学》(Acta Pharmacol Toxicol,Copenh)发表芬兰Turku大学生理系、芬兰职业卫生研究所HIETANEN Eet al.《苯氧除草剂和草甘膦对大鼠肝脏和肠道生物转化活性的影响》确认:
材料和方法
给雄性Wistar大鼠(358 495 g)除草剂,...以草甘膦(N-膦酰基巯基甘氨酸)为异丙胺盐,最初剂量为500 mg / kg,持续4天,然后于在剩余的给药期中为300 mg / kg。 在整个给药期间,对照组接受0.9%的盐水(4 ml / kg),阳性对照组给予氯贝贝特(Klofiran,Remeda Ltd,Kuopio,芬兰),剂量为200 mg / kg。草甘膦(Roundup @,孟山都(Monsanto)...
最后一次给药后24小时将大鼠处死。 取出肝脏和一段20厘米长的近端小肠,放入冰冷的0.25 M蔗糖中。 ...
在胃内暴露2周的大鼠体内研究了苯氧酸除草剂2,4-D(2,4-二氯苯氧乙酸)和MCPA(4-氯-2-甲基苯氧乙酸),氯贝贝酸盐和草甘膦对肝和肠药物代谢酶活性的影响。
草甘膦降低了肝细胞色素P-450的含量和单加氧酶的活性,降低了芳烃羟化酶的肠道活性。草甘膦,与苯氧基酸在化学上不相关,似乎抑制了单加氧酶。这些变化是否与这些异源生物的毒性有关,还有待进一步实验加以阐明。
HIETANEN Eet al.,Effects of phenoxyherbicidesand glyphosate on the hepatic and intestinal biotransformation activitiesin the rat. Acta Pharmacol Toxicol(Copenh), 1983,53(2):103-112.
HIETANEN Eet al.,苯氧除草剂和草甘膦对大鼠肝脏和肠道生物转化活性的影响。药理学毒理学(Copenh),1983,53(2):103-112.
https://pubmed.ncbi.nlm.nih.gov/6624478/
3-3 阿根廷农学与兽医、遗传学学者2009年研究证实“在本研究中,草甘膦在人肝癌细胞系Hep-2细胞的彗星试验中以及在小鼠暴露400 mg / kg的MNT试验中具有遗传毒性。”
证据06(2009年1月):《环境毒理学与药理学》(Env.Tox.and Pharmacology)发表阿根廷Río Cuarto国立大学(UNRC)农学与兽医学院(FAV)、阿根廷布宜诺斯艾利斯自治市国家医学科学院遗传学系、阿根廷CONICETFernando Mañasacet al.《通过彗星试验和细胞遗传学测试评估草甘膦的遗传毒性》确认:
一些监管机构已经对草甘膦和农达除草剂的安全性进行了审查,并得出结论认为,没有迹象表明应对人类健康感到担心(EPA, 1993; WHO, 1994; Williams et al., 2000)。
但是,最近的研究表明,这种除草剂可能不如以前认为的安全((Isenring, 2004; Caglar and Kolankaya, 2008)。 其他作者认为,空中喷洒添加表面活性剂溶液草甘膦除草剂与厄瓜多尔哥伦比亚边境地区人口的遗传改变之间存在关联(Paz-y-Mino et al., 2007)和接触草甘膦的农药使用者中的癌症发生率之间也存在关联(De Roos et al., 2005)。
迄今为止,对草甘膦的遗传毒性进行了评估,结果具有异质性。在Hep-2细胞中进行了彗星分析。对于草甘膦,在浓度范围为3.00至7.50 mM时,对照组(5.42±1.83任意单位)的DNA损伤水平已显示出草甘膦的显着增加(p <0.01)。在人类淋巴细胞的染色体畸变(CA)测试中,除草剂(0.20–6.00 mM)与对照组相比没有显着影响。在体内,以三种剂量在小鼠中评估了微核试验(MNT),在400 mg / kg时统计学显着增加(13.0±3.08微核红细胞/ 1000细胞,p <0.01)。
在本研究中,草甘膦在人肝癌细胞系Hep-2细胞的彗星试验中以及在小鼠暴露400 mg / kg的MNT试验中具有遗传毒性。定量其器官中的硫代巴比妥酸反应性物质(TBARs)水平,超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性。结果显示这些酶活性增加。
Fernando Mañasacet al., Genotoxicity of glyphosate assessed by the comet assay and cytogenetic tests. Env.Tox.and Pharmacology, July 2009; 28(1)p37-41
Fernando Mañasacet al.,通过彗星试验和细胞遗传学测试评估草甘膦的遗传毒性。环境毒理学与药理学,2009年7月;28(1)p37-41
https://www.sciencedirect.com/science/article/pii/S1382668909000258
3-4 巴西五家大学学者团队2012年研究确认:“即使以低剂量和相对较短的时间接触草甘膦除草剂农达(Roundup®),也可能引起严重的肝脏和血液学损害...导致严重的人类健康问题,包括肝脏损害、贫血和与ROS相关的疾病,例如不同类型的癌症和神经退行性疾病。”
证据07(2012年9月):《跨学科毒理学》(Interdiscip Toxicol.)发表巴西Alto Vale do Rio de Peixe大学、巴西Pernambuco联邦大学工业生物技术研究生课程,巴西Cidade大学抗生素系、巴西Estado大学Agroveterinário中心兽医学系、巴西圣卡塔琳娜州Oeste大学药学系Raquel Jasperet al.《暴露于草甘膦除草剂农达的小鼠的生化,血液和氧化参数的评估》确认:
全球的监管机构和科学机构得出的结论是,草甘膦不会对人类健康构成威胁(Williams et al., 2000)。但是,最近的研究表明,长期接触该化学物质可对怀孕大鼠产生毒性、胎儿的骨骼发育不足(Dallegrave, 2003)、细胞代谢发生变化(Marc et al., 2004a; 2004b)、皮肤损伤(Amerio et al., 2004),以及非霍奇金淋巴瘤的发生率增加(De Ross et al., 2003)。此外,使用低剂量的草甘膦除草剂-Biocarb®的研究表明,该产品可引起显着的肝功能改变以及鼻腔出血,而不会干扰血小板聚集(Benedetti et al., 2004; Neiva et al., 2010)。
血细胞比容、血红蛋白以及红细胞和白细胞数量等血液学参数可以用作毒性指标,在环境和职业监测中具有广泛的应用潜力(Sancho et al., 2000; Barcellos et al., 2003)。
肝和肾功能以及氧化应激的生化标志物对于生物监测环境污染物的暴露很重要(Ahmad et al., 2004)。
许多污染物会诱发生物系统的损害,包括损害哺乳动物体内排毒和生物转化过程的主要场所肝脏,其中包括活性氧(ROS)的形成,例如过氧化氢(H2O2)、超氧阴离子(O2-)和羟基(·OH)(Ahmad et al., 2000; Harish & Murugan, 2011)。由于它们的高反应性,它们会破坏脂质、蛋白质、碳水化合物和核酸(Avellar et al., 2004),从而严重危害健康。
为了中和活性氧(ROS),动物拥有一种抗氧化剂防御机制,该机制由包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)和谷胱甘肽还原酶(GR)在内的酶以及非酶类抗氧化剂组成,包括非蛋白硫醇,尤其是谷胱甘肽(GSH)。当生物体的防御能力不足以中和ROS时,可能会发生氧化损伤,其中最严重的一种是膜脂质过氧化(Scandalios, 2005)。在几种鱼类中已有报道(Sevgiler et al., 2004; Glusczak et al., 2006; 2007; Modesto & Martinez, 2010a)。同时,抗氧化剂酶的活性以及氧化损伤的发生已被提出作为污染物引起的氧化应激的指标(Ahmad et al., 2000; Li et al., 2003)。
鉴于草甘膦除草剂农达(Roundup®)使用在增加,并且缺乏有关其在哺乳动物中毒性的信息,这项工作的目的是使用雄性和雌性白化病瑞士老鼠评估该产品对血液、生化和氧化应激参数的影响。
我们评估了草甘膦除草剂农达(Roundup®)对雄性和雌性白化病瑞士小鼠的肝脏、血液学和氧化作用的毒性。每天以50或500 mg/kg体重的除草剂口服对动物服药,为期15天。蒸馏水用作对照处理。
在治疗结束时收集血液和肝组织样品。通过定量分析血清酶ALT,AST和γ-GT监测肝毒性,以及尿素和肌酐对肾脏的毒性。我们还组织病理学调查了肝组织。血液学参数的变化通过RBC,WBC,血红蛋白,血细胞比容,MCV,MCH和MCHC进行监测。在肝脏中分析了TBARS(硫代巴比妥酸反应性物质)和NPSH(非蛋白质硫醇),以评估氧化损伤。
两种除草剂处理均观察到肝酶(ALT,AST和γ-GT)水平显着增加,但通过组织学分析未发现明显差异。
血液学参数显示出明显的变化(500 mg/kg体重),在小鼠和雌性小鼠中红细胞、血细胞比容和血红蛋白的减少以及MCV的显着增加。在雄性中,两种剂量水平的脂质过氧化作用均显着增加,并且肝组织中的NPSH降低,而在雌性中,只有在较高的剂量率下,这些参数才会发生显着变化。
该项研究的结果表明,即使以低剂量和相对较短的时间接触草甘膦除草剂农达(Roundup®),也可能引起严重的肝脏和血液学损害,可能是由氧化应激增加引起的。全球广泛使用不同的草甘膦制剂,突显了这一发现的重要性。 长期暴露于受污染的土壤或水中存在的草甘膦,即使浓度很低,也可能导致严重的人类健康问题,包括肝脏损害、贫血和与ROS相关的疾病,例如不同类型的癌症和神经退行性疾病。
Raquel Jasperet al., Evaluation of biochemical, hematological and oxidative parameters in mice exposed to the herbicide glyphosate-Roundup(®), Interdiscip Toxicol. 2012 Sep;5(3):133-40.
Raquel Jasperet al.,暴露于草甘膦除草剂农达的小鼠的生化,血液和氧化参数的评估。跨学科毒理学。2012年9月;5(3):133-40.
https://pubmed.ncbi.nlm.nih.gov/23554553/
3-5 英国、意大利医学家与法国科学家塞拉利尼团队合作2015年发表大鼠暴露超低微量草甘膦除草剂农达两年研究,“发现肝脏和肾脏中4224和4447转录簇(一组对应于已知或推定基因的探针)的表达分别发生了变化(p <0.01,q <0.08)。肝脏中基因表达的变化范围为-3.5倍至3.7倍,肾脏为-4.3倍至5.3倍。”
证据08(2015年8月):《环境卫生》(Environmental Health)发表伦敦国王学院医学与分子遗传学系生命科学与医学学院基因表达与治疗小组、伦敦国王学院基因组学中心、意大利Verona大学神经与运动科学系、法国卡昂大学生物研究所Robin Mesnage et al.《转录组概况分析反映了慢性超低剂量草甘膦除草剂农达暴露后大鼠肝脏和肾脏的损伤》确认:
草甘膦的除草剂(GBH),例如农达(Roundup),是世界范围内使用的主要农药。... 通常在食品中检测出草甘膦的除草剂(GBH)残留[1, 2],还发现雨水,地表径流和浸出水污染了饮用水,从而增加了可能的暴露途径[3]。关于人体中草甘膦除草剂(GBH)残留负担的流行病学数据非常有限,但证据表明草甘膦及其代谢产物广泛传播[4]。
草甘膦除草作用的主要方式是抑制植物和某些细菌中存在莽草酸芳香氨基酸生物合成途径中的5-烯丙基丙酮酸莽草酸-3-磷酸合酶(EPSPS)。由于在脊椎动物中不存在这种途径,因此一般认为草甘膦对包括人类在内的哺乳动物的健康危害最小[5]。但是,越来越多的证据表明,草甘膦除草剂(GBH)残留物对肾和肝功能构成特殊风险。
草甘膦在肝脏中的作用最早是在1980年代观察到的,包括其破坏肝脏线粒体氧化磷酸化的能力[6]。草甘膦可以充当质子体,增加线粒体膜对质子和Ca2 +的渗透性[7],它可以触发活性氧的产生,导致观察到的氧化应激[8]。在美国饮用水中草甘膦允许浓度为700μg/ L的情况下,亚慢性暴露于草甘膦除草剂(GBH)后,在大鼠肝脏和肾脏中检测到氧化应激标志物升高[9]。在75天内每2天摄入4.87 mg / kg体重草甘膦的大鼠中检测到肝组织学变化和临床生化改变[10]。
在各种实验动物和农场动物中进行的代谢研究表明,肾脏和肝脏组织中草甘膦和氨基甲基膦酸(AMPA,草甘膦的主要分解产物)比在脂肪、肌肉和大多数其他组织中的含量高10到100倍甚至更高[11]。 在农场动物中,草甘膦尿液水平的升高与血清参数的变化相关,这些参数表明肝脏和肾脏的氧化应激和营养物中微量元素被消耗[12]。
除这些细胞毒性作用外,研究表明草甘膦除草剂(GBH)可以破坏多种内分泌信号传导系统,包括雌激素[13]和视黄酸[14]。 内分泌干扰作用可以解释暴露于亚致死剂量的草甘膦除草剂(GBH)的大鼠的生殖发育损伤[15]。 已经提出了对视黄酸信号通路的影响以解释草甘膦除草剂(GBH)在哺乳动物[16]和两栖动物[14]中的潜在致畸作用。
尽管如此,应该指出的是,对草甘膦除草剂(GBH)毒性研究的大多数结果都是在远高于一般人群草甘膦暴露的剂量下获得的。测试的剂量典型超过目前在欧盟内部设定为0.3 mg / kg bw /天或在美国设定为1.75 mg / kg bw /天的每日可接受摄入量(ADI),它们是基于大鼠慢性暴露后肝毒性测试结果制定的,尽管没有在终生实验中研究草甘膦除草剂(GBH)毒性。
为了解决这个问题,进行了一项为期2年的研究,其中以含0.1ppb草甘膦除草剂农达水平对大鼠提供饮水,从而不仅含有草甘膦而且还含有佐剂[17]。草甘膦当量浓度为0.05μg/ L,对应于欧盟(0.1μg/ L)和美国(700μg/ L)允许的浓度。
解剖形态学和血液/尿液生化变化的发生率显着增加,表明肝脏和肾脏的结构以及功能性病理。为了证实这些发现,我们对这些相同动物的肝脏和肾脏进行了转录组微阵列分析。
结果:
发现肝脏和肾脏中的4224和4447转录簇(一组对应于已知或推定基因的探针)的表达分别发生了变化(p <0.01,q <0.08)。肝脏中基因表达的变化范围为-3.5倍至3.7倍,肾脏为-4.3倍至5.3倍。在这两种组织中表达均发生变化的1319个转录簇中,发现了868个基因中3个功能类别的本体富集。
首先,参与mRNA剪接和小核仁RNA的基因大部分被上调,表明正常剪接体活性被破坏。肝细胞的电子显微镜分析证实了核仁结构破坏。其次,控制染色质结构的基因(尤其是组蛋白-赖氨酸N-甲基转移酶)大部分被上调。第三,与呼吸链复合物I和三羧酸循环有关的基因大多被下调。途径分析表明mTOR和磷脂酰肌醇信号通路的调节。
长期给予超低剂量草甘膦除草剂农达(Roundup)所引起的基因紊乱反映出肝脏和肾脏的脂毒性状况以及细胞生长的增加,这可能与对毒性作用引起组织损伤的再生反应有关。观察到的基因表达变化与纤维化、坏死、磷脂酰化、线粒体膜功能障碍和局部缺血一致,这与解剖学、组织学和生化水平相关并因此证实了病理学观察。
结论:我们的结果表明,在建立的实验室动物毒性模型系统中以超低环境剂量长期暴露于草甘膦除草剂(GBH)可能导致肝和肾损害,并对动物和人类健康产生潜在的重大影响。
Robin Mesnageet al., Transcriptome profile analysis reflects rat liver and kidney damage following chronic ultra-low dose Roundup exposure. Environmental Health. 25 Aug 2015;14:70
Robin Mesnageet al.,转录组概况分析反映了慢性超低剂量草甘膦除草剂农达
暴露后大鼠肝脏和肾脏的损伤。2015年8月25日;14:70
https://ehjournal.biomedcentral.com/articles/10.1186/s12940-015-0056-1
3-6 美国、英国、加拿大多机构科学家团队2016年发表的《关于使用草甘膦类除草剂的担忧和与暴露有关的风险:共识声明》揭露食品中草甘膦除草剂残留对动物与人类肝肾造成一系列多方面危害。
证据09(2016年2月):《环境卫生》(Environmental Health)发表美国弗吉尼亚州Charlottesville市环境卫生科学并美国宾夕法尼亚州匹兹堡Carnegie Mellon大学兼职教授;英国伦敦国王学院生命科学与医学学院医学与分子遗传学系;美国加州大学Irvine分校,发育和细胞生物学系;美国内华达州Paonia的内分泌干扰交流所;美国加州L. Everett&Associates;美国纽约州Yonkers市消费者联盟;美国纽约州Mount Sinai伊坎医学院预防医学系;加拿大温哥华市British Columbia大学儿童医院儿童与家庭研究所;美国马萨诸塞大学公共卫生与健康科学学院环境卫生科学系-美国Massachusetts大学生物科学系、生物医学系;美国俄勒冈州Benbrook咨询服务公司John Peterson Myerset al.《关于使用草甘膦类除草剂的担忧和与暴露有关的风险:共识声明》确认:
广谱草甘膦除草剂(通用商品名为农达“ Roundup”)于1974年出售给农民。自1970年代后期以来,草甘膦基除草剂(GBH)的使用量增加了约100倍。施用量的增加可能是由于广泛出现的杂草抗草甘膦和新的收获前的干燥剂使用方式所致。草甘膦基除草剂(GBH)的开发是为了替代或减少对除草剂的依赖,这些除草剂会引起有据可查的与漂移和农作物损害,功效下降以及人类健康风险相关的问题。
最初的草甘膦行业毒性测试表明,草甘膦除草剂(GBH)对包括哺乳动物在内的非目标物种构成的风险相对较低,导致全球监管机构设定了较高的可接受的暴露限值。为了适应与转基因的耐除草剂农作物相关的草甘膦除草剂(GBH)使用模式的变化,监管机构大大提高了玉米、油料种子(大豆和低芥酸菜籽)以及苜蓿作物和相关牲畜饲料的草甘膦耐受水平。
然而,近十年来发表的动物和流行病学研究指出,需要重新审视草甘膦的毒性。此外,世界卫生组织的国际癌症研究机构(IARC)最近得出结论,草甘膦“可能对人类致癌”。
食品中发现草甘膦残留物
草甘膦除草剂(GBH)被广泛用于包括玉米、大豆、低芥酸菜子、小麦、大麦和食用豆在内的多种农作物[9]。 草甘膦除草剂(GBH)在这些农作物上的应用可以会造成收获的农作物及其加工食品中存在草甘膦及其主要代谢物AMPA的残留[13]。
例如,英国食品标准局2012年10月进行的食品残留物测试发现,在109个面包样品中,有27个(24.77%)样品中的草甘膦残留量为0.2 mg / kg或以上[14]。 美国农业部2011年进行的测试状况表明,在300个大豆样品中,90.3%个大豆样品草甘膦残留为1.9 ppm,95.7%个大豆样品草甘膦代谢物AMPA残留为2.3 ppm[13]。 近年来,其他实验室报告的大豆水平更高(例如[15, 16])。
收获前,使用草甘膦除草剂(GBH)作为收割辅助措施是导致某些谷类食品中残留频率和含量增加的重要新贡献。 在英国这样的潮湿、温带气候国家中尤其如此。 在收获后的一到两周内进行这样的施用,以加速作物干燥,从而使收获操作能够更快开始(所谓的“绿色燃尽”用途[17])。 与在作物生长周期较早阶段接受典型施用量的农作物相比,此类后期施用通常会导致最终收获产品中的草甘膦/AMPA残留水平高得多。 草甘膦除草剂(GBH)的种植前施用以及收获后或休耕期的施用导致谷物、油料种子或草料作物中很少可检测到的草甘膦/AMPA残留。
为了应对不断变化的草甘膦除草剂(GBH)使用模式以及对潜在危害的科学理解的不断发展,我们提出了一份与草甘膦除草剂(GBH)安全相关的新兴科学的关注声明。我们的关注声明考虑了当前出版的描述草甘膦除草剂(GBH)用途、作用机理、实验动物毒性和流行病学研究的文献。它还审查了当前人类安全标准派生的问题。
我们得出以下结论:
(1)草甘膦除草剂(GBH)是世界上使用最广泛的除草剂,其使用量还在不断增加;
(2)在全球范围内,草甘膦除草剂(GBH)经常污染饮用水源、降水和空气,特别是在农业地区;
(3)草甘膦在水和土壤中的半衰期比以前认为的要长;
(4)草甘膦及其代谢产物广泛存在于全球大豆供应中;
(5)人类对草甘膦除草剂(GBH)的暴露程度正在上升;
(6)草甘膦目前已经被权威地归类为“可能的人类致癌物”;
(7)美国和欧盟对草甘膦的“每日容许摄入量”的监管估计是基于过时的科学。
我们提供了一系列在流行病学研究、生物监测和毒理学研究中利用内分泌学原理来确定草甘膦除草剂(GBH)的影响是否是由于内分泌干扰活动引起的建议。 我们建议,应优先考虑草甘膦除草剂(GBH)的常见商业制剂,以使其包含在政府主导的毒理学测试计划,例如包含到美国《国家毒理学计划》以及美国疾控中心进行的生物监测中。...
来自人类和实验动物的数据表明与暴露有关的危害
经典的毒性研究评估了高剂量并检查了“经过验证的”终点(已在许多实验室中证明易于复制的终点)[18]。 尽管已知这些终点代表不良结果,但它们通常与人类疾病不相关,并且不被认为对所有毒理学终点都是全面的[19, 20]。 在啮齿类动物中进行的长期监管(2年)毒性研究表明,草甘膦对肝脏和肾脏有不良影响(在[3, 4]中进行了综述)。 然而,这些研究通常不能解决由内分泌系统介导的发育或代谢过程破坏引起的广泛的潜在不良反应[3, 21-24]。 对低剂量草甘膦除草剂(GBH)进行研究的研究表明,这些化合物可以诱导肝肾损害[25-28],而草甘膦除草剂(GBH)在目前通常被认为对人类“安全”的范围内。
我们有把握地估计:
草甘膦在目前被监管机构认为“安全且可以接受的”暴露水平下,通过破坏线粒体代谢[57-59],从而激发大鼠肝脏和肾脏的氧化损伤[4, 25, 26]。因此,“可接受每日摄入量”(ADI)对草甘膦除草剂(GBHs)的暴露量被高估了。影响其他终点的不良影响尚不确定,但仍令人担忧,表明需要进行更深入的研究(请参阅以下部分)。
来自草甘膦除草剂(GBH)的残留物可能对肾脏和肝脏构成更高的风险。在各种实验室和农场动物物种中进行的代谢研究表明,肾脏和肝脏组织中草甘膦和AMPA的水平,比脂肪、肌肉(肉)和大多数其他组织中的水平高10到100倍(或更多)。...
草甘膦是一种螯合剂,可以螯合对健康必需的微量营养素金属,例如锌、钴和锰[67, 68]。 草甘膦除草剂(GBHs)的这一特性可以改变这些微量营养素对农作物、人、野生生物、宠物和牲畜的可用性。 这些微量营养素是酶的辅助因子,因此它们的损失有可能造成许多有害作用,尤其是对肾脏和肝脏功能的损害[69]。...
支持当前草甘膦除草剂(GBH)监管风险评估的毒理学数据已过时,不足以判断当代草甘膦和AMPA暴露水平对发育中的哺乳动物胎儿,肝脏和肾脏以及人类和其他多种动物生殖结局的影响[3, 25]。
John Peterson Myerset al., Concerns over use of glyphosate-based herbicides and risks associated with exposures: a consensus statement. Environmental Health. 17 Feb 2016;vol15, 19
John Peterson Myerset al.,关于使用草甘膦类除草剂的担忧和与暴露有关的风险:共识声明。环境卫生。2016年2月17日;第15卷19
https://ehjournal.biomedcentral.com/articles/10.1186/s12940-016-0117-0
3-7 英国、意大利医学家与法国科学家塞拉利尼团队合作2017年发表大鼠暴露超低微量草甘膦除草剂农达两年试验造成肝组织蛋白质严重干扰(检测到1906种中的214种被干扰)、代谢物干扰(检测的673种代谢物中有55种代谢产物发生变化),证实了慢性超低剂量草甘膦除草剂(GBH)暴露引起的肝功能障碍。
证据10(2017年1月):《自然杂志--科学报告》(Nature -- Science Report)发表伦敦国王学院生命科学与医学学院医学和分子遗传学系基因表达与治疗小组、伦敦国王学院蛋白质组学设施精神病研究所、卡昂大学生物研究所Mesnage Ret al.《长期暴露于超低剂量的农达除草剂后,代谢多组学揭示了大鼠非酒精性脂肪性肝病》确认:
低环境相关剂量的草甘膦基除草剂(GBH)对肝脏功能的损害仍然是有争议且尚未解决的问题。先前我们已经证明,以抗消化性血液学检查显示,以0.1 ppb(50 ng / L草甘膦当量稀释度;4 ng / kg体重/天每天摄入量)服用2年的草甘膦基除草剂农达(Roundup GBH)制剂的大鼠显示出肝损伤增强的迹象、血液/尿液生化变化和转录组分析变化。
在这里,我们提出了一项结合代谢组学和蛋白质组学肝分析的多组学研究,以进一步了解由草甘膦除草剂农达引起的病理。与有机氮代谢和脂肪酸β-氧化有关的蛋白质被严重干扰(检测到1906种中的214种被干扰,p<0.05)。蛋白质组紊乱反映了过氧化物酶体增生、脂肪变性和坏死。
代谢组学分析(检测的673种代谢物中有55种代谢产物发生变化,p <0.05),通过显示谷胱甘肽和抗坏血酸自由基清除剂系统的激活确认脂毒性条件和氧化应激。此外,我们发现了与肝毒性相关的代谢物改变,例如γ-谷氨酰二肽、酰基肉碱和脯氨酸衍生物。
这些分子特征的变化与非酒精性脂肪性肝病(NAFLD)的生物标志物及其向非炎性亚型非酒精性脂肪性肝病(NASH)非炎性亚型非酒精性脂肪性肝病(NASH)的进展基本上重叠。
总体而言,代谢组和蛋白质组紊乱与非酒精性脂肪肝疾病的生物标志物以及其发展为脂肪性肝病的生物学标志物存在实质性重叠,因此证实了慢性超低剂量草甘膦除草剂(GBH)暴露引起的肝功能障碍。
方法
实验设计。这项研究中分析的大鼠组织是从先前所述动物获得的[18]。简而言之,实验方案如下。适应20天后,将5周龄的Harlan Sprague-Dawley大鼠按体重随机分为10只动物。
在两年内,给动物饲喂包括33%玉米DKC 2675的标准饮食A04(法国Safe)。所有饲料配方均由均衡饮食组成,化学计量基本等同。将所有动物饲养在聚碳酸酯笼子中(820cm 2,法国Genestil)。实验室内每个笼子的位置定期更改。垃圾(Toplit classic,Safe,法国)每周更换两次。
10只动物的组可使用普通水(对照饮水)或补充了1.1×10-8%的草甘膦除草剂农达(0.1 ppb或0.05 μg/L草甘膦当量稀释液)的相同水。 使用的草甘膦除草剂农达(Roundup)的商业配方是“Grand Travaux Plus”(450 g / L草甘膦,批准号2020448;比利时孟山都)。通过液相色谱-质谱(HPLC-MS)测定草甘膦的浓度,可以确认饮用水中所需的农达稀释水平。 类似地,在两次制备测试处理溶液之间的7天时间内研究并验证了溶液中草甘膦的稳定性。
组织取样
在研究过程中的每天的同一时间处死动物,或者遵守动物福利法规,以避免不必要的痛苦(例如,体重减轻25%,体重超过25%的肿瘤的存在,出血性出血或虚脱导致的痛苦)或在2年研究期结束时。在异氟烷麻醉下放血处死动物。将肝脏分成两半并在液氮/干冰中速冻,并保存在-80℃下。
Mesnage Ret al., Multiomics reveal non-alcoholic fatty liver disease in rats following chronic exposure to an ultra-low dose of Roundup herbicide. Sci Report.2017 Jan 9;7:39328.
Mesnage Ret al.,长期暴露于超低剂量的农达除草剂后,代谢多组学揭示了大鼠非酒精性脂肪性肝病。自然杂志--科学报告。2017年1月;;7:39328.
https://pubmed.ncbi.nlm.nih.gov/28067231/
3-8 克罗地亚、墨西哥医学家团队2018年6月发表研究确认:监管机构允许的低剂量草甘膦除草剂28天造成“Wistar大鼠肝脏、全血和血浆中的氧化应激、胆碱酯酶活性和DNA损伤”。
证据11(2018年6月):《工作卫生与毒理学档案》(Arh Hig Rada Toksikol)发布克罗地亚医学研究与职业卫生研究所、墨西哥特拉斯卡拉州 Tlaxcala自治大学农业生物学系基因组毒理学和环境化学实验室Mirta Milićet al.《草甘膦暴露28天后,Wistar大鼠肝脏、全血和血浆中的氧化应激、胆碱酯酶活性和DNA损伤》确认:
啮齿动物的短期研究没有显示出明显的毒性作用[32]。终生暴露证明肝肾功能不全和毒性[33],妊娠大鼠胎儿骨化缺乏[34],患癌风险大大增加以及寿命缩短[13]。为期两年的一项大鼠研究[35]证明了尿液和器官生化参数以及蛋白质组学和代谢组学特征的变化[35]。尽管草甘膦的毒性可能与剂量和物种有关[36] -水生生物似乎更加敏感-新的研究将其关注程度从急性提高到了慢性,亚慢性和生殖毒性,但相关性更高[37]。
我们对草甘膦毒物代谢动力学的了解基于孟山都公司[38-40]的大鼠研究、美国国家毒理学计划[41],草甘膦衍生的放射性组织研究(10 mg kg-1或更高剂量的处理)[42, 43],以及Williams等人对国际癌症研究机构(IARC),欧洲食品安全机构(EFSA)和美国环保署(EPA)进行的致癌性研究的评论[9, 14, 15, 19, 44, 45]。鉴于知识有限,我们需要进一步研究草甘膦多剂量的毒代动力学特征,其范围从低到高,以了解机理和生物学途径中的关键事件以及时间或剂量依赖性[45]。研究低剂量的原因是有害作用的新证据[2, 35, 46, 47],与状况随亚慢性和慢性暴露的进一步恶化[35, 37]。
在农业和非农业工人、孕妇和儿童的人尿和血液中发现的草甘膦痕迹[2, 14, 48-52]表明长期暴露于环境中的风险更高[53]。
基于这些新研究的证据和我们自己的证据[46],我们决定进一步研究亚致死性环境相关(据称“对人体安全”)剂量的草甘膦在大鼠中的毒理学机理和作用,以观察它们如何影响:a)体重和肝脏重量;b)胆碱酯酶(ChE),AChE和丁酰胆碱酯酶(BChE)活性;c)氧化应激指标(脂质过氧化,活性氧,GSH和GSH-Px);和d )白细胞和中小型肝细胞中主要DNA损伤的水平,所有这些都是草甘膦机制和作用的既定标志物。
在该项28天的研究中,我们评估了通过管饲法向Wistar大鼠施用除草剂草甘膦对Wistar大鼠的影响,其剂量等于操作者可接受的暴露水平(AOEL)的0.1、消费者可接受的每日摄入量(ADI)的0.5、1.75mg/kg(对应调整为慢性人群调整剂量(cPAD)和10 mg/kg体重(bw)(相当于AOEL的100倍)。在每次处理结束时,测量体重和肝脏重量,并将其与基线值进行比较。用碱性彗星试验估计白细胞和肝组织中的DNA损伤。使用一系列端点评估氧化应激,以通过硫代巴比妥反应性物质(TBARS)水平、活性氧水平(ROS)、谷胱甘肽(GSH)水平和谷胱甘肽过氧化物酶(GSH-Px)活性建立脂质过氧化作用。还测量了总胆碱酯酶活性和乙酰胆碱酯酶(AChE)和丁酰胆碱酯酶(BChE)的活性。
暴露的动物体重增加少于对照组。处理导致肝细胞和白细胞中较高的初级DNA损伤。草甘膦暴露可显着降低AOEL,ADI和cPAD组肝脏中的TBARS,以及AOEL和cPAD组血浆中的TBARS。所有处理均抑制了AChE,但是AOEL和ADI组与对照组有显着差异。总的ChE和血浆/肝脏ROS / GSH水平与对照组无显着差异,除了AOEL组和ADI组的ChE下降35%,cPAD和100xAOEL组的肝脏GSH显着下降。与对照组相比,AOEL组和ADI组血液中的GSH-Px活性显着下降,但在肝脏中,ADI组、cPAD组和100xAOEL组中的GSH-Px活性显着增加。
所有这些发现表明,即使暴露于低水平的草甘膦也可能产生严重的不利影响,并表明有必要改变低水平的慢性/亚慢性草甘膦暴露的风险评估方法,因为氧化应激不一定与破坏和抑制AChE的遗传风险相关。
Mirta Milićet al., Oxidative stress, cholinesterase activity, and DNA damage in the liver, whole blood, and plasma of Wistar rats following a 28-day exposure to glyphosate.
Arh Hig Rada Toksikol, 2018 Jun 1;69(2):154-168.
Mirta Milićet al.,草甘膦暴露28天后,Wistar大鼠肝脏、全血和血浆中的氧化应激、
胆碱酯酶活性和DNA损伤。工作卫生与毒理学档案
https://pubmed.ncbi.nlm.nih.gov/29990293/
4、中国学者众多研究揭露草甘膦除草剂对大鼠肝脏及其功能、对肝微粒体酶、对肝细胞;对鲫鱼干细胞;对中华绒螯蟹幼蟹的肝胰腺、肝细胞;对罗非鱼肝功能、肝脏病理病变;对草甘膦生产工人肝脏及其功能;对草甘膦中毒患者肝功能等,造成一系列损害。
4-1 贵阳医学院学者团队1984年发表对草甘膦原药三个月亚急性毒性实验毒性研究揭示“750、250 毫克/公斤两组部分动物肝脏可见细胞浊肿和点状坏死,肾小管上皮细胞浊肿、脾淤血等病变,结合肝功能的改变,表明长期接触高剂量草甘膦,对实质器官有一定损害。”
证据12(1984年2月):《环境科学》发表贵阳医学院朱延韦、蒋宪瑶、覃国芳、蒙顺松、张爱华、葛庆华、姜体蓉、许庭良、梁文妹《新除草剂——草甘膦的毒性研究》确认:
三、亚急性毒性实验
1 . 材料和方法
药物同蓄积试验(用9.72%的草甘膦工业品水剂,蒸馏水稀释)。
动物:体重80-120克的健康大鼠80只, 随机分为五组,每组16只(雌雄各半),设四个给药组,一个对照组,各给药组每天以草甘膦溶液灌胃(每周六天,体积为 1 毫升/100克),剂量为750、250、90、30 毫克/公斤,对照组灌以同体积的蒸馏水。实验期为三个月。
观察指标:动物的活动、饮食等一般状况,体重(每周称一次);实验期间死亡的动物作病理检查;实验三个月末取尾血查血常规、 全血胆碱醋酶;股动脉放血处死全部动物,查血清谷--丙转氨酶(SGPT)、尿素氮;称肝、肾、脾、睾丸等脏器的重量,取肝、肾、脾 、肾上腺、睾丸、小肠、大 肠作病理学检查。
2. 结果与讨论
给药数数天后,750、250 毫克/公斤组部分动物出现腹泻、进食量减少、活动少等症状,体重下降。两周后,250 毫克/公斤组动物逐 渐适应,腹泻停止,体重增加。750 毫克/公斤 组动物的中毒症状逐步加重,萎糜不振,是抑制状态,并相继死亡7只。其余三组动物无异常表现,体重持续增长,与对照组比无显著差异。
血常规、血清尿素氮、全血胆碱醋酶各剂量组与对照组比,差异不显著。SGPT 750,250 毫克/公斤两组比对照组显著增高(P < 0.05)。
各脏器的肉眼检查及脏器系数均未发现异常。病理组织学检查,750、250 毫克/公斤两组部分动物肝脏可见细胞浊肿和点状坏死,肾小管上皮细胞浊肿、脾淤血等病变,结合肝功能的改变,表明长期接触高剂量草甘膦,对实质器官有一定损害。
以上结果说明,剂量30 毫克/公斤的草甘膦给大鼠连续灌胃三个月,各项指标未发现异常,可作为最大无作用剂量。
朱延韦、蒋宪瑶、覃国芳,新除草剂——草甘膦的毒性研究,环境科学,1984(2)
http://www.cnki.com.cn/Article/CJFDTOTAL-HJKZ198402014.htm
4-2 同济医科大学公共卫生学院环境毒理学研究室1995年与1996年研究确认:“体内试验中,草甘膦能显著诱导增加微粒体细胞色素P(450)含量,具有显著意义。并且可使还原型谷胱甘肽的含量显著增加,具有极显著意义。... 体外试验中...在0.0000001 - 0.0001 mol/L时可增加还原型谷胱甘肽的含量,且呈明显剂量效应关系。”。
证据13(1995年4月):《卫生毒理学杂志》发表同济医科大学环境毒理教研室严红、邬惠琼、柴莲花、王新刚《草甘膦对大鼠肝微粒体酶活力的影响及其机理初探》确认:
试验材料:草甘膦纯品,含量> 9 %,由湖北沙隆达股份有限公司提供。
实验动物:成年雄SD大鼠43只,体重180 - 220 g,由本校实验动物学部提供。
结果表明,体内试验中,草甘膦能明显增加细胞色素P450含量,诱导氨基比林N-脱甲基酶(APND)和乙基吗啡N-脱甲基酶(EMND)的活力;体外试验中,在3.3×10-8~3.3×10-4 mol/L浓度范围内,未见草甘膦对P450含量有明显增加,而在2x10-6mol/L和2.5x10-5-2x10-4mol/L浓度范围内可分别对APND和EMND呈现诱导作用,在2x10-8- 2x10-4 mol/L浓度范围内,随草甘膦浓度增高,APND和EMND活力均有上升趋势。
初步观察结果,草甘膦在体内对肝微粒体酶诱导作用机理与其促进蛋白质合成作用有关。
严红、邬惠琼et al.,草甘膦对大鼠肝微粒体酶活力的影响及其机理初探,
卫生毒理学杂志,1995(4)
http://www.cnki.com.cn/Article/CJFDTotal-WSDL504.001.htm
证据14(1996年5月):《同济医科大学学报》发表同济医科大学公共卫生学院环境毒理学研究室邬惠琼、毛新良、严红、王新刚、柴莲花获“国家自然科学基金资助项目(No.391706600 )”《除草剂草甘膦对大鼠肝微粒体酶及脂质过氧化作用的影响》确认:
通过体内和体外试验,研究了草甘膦对大鼠肝微粒体酶、脂质过氧化作用及还原型谷胱甘肽的影响。
试验材料:草甘膦纯品,含量> 9 %,由湖北沙隆达股份有限公司提供。
实验动物:成年雄SD大鼠43只,体重180 - 220 g,由本校实验动物学部提供。
体内试验结果表明:
草甘膦能显著诱导增加微粒体细胞色素P(450)含量,与对照组比较[x±s(下同)分别为(0.68±0.12)、(0.59±0.09)μmol/g]具有显著意义(P<0.05)。并且可使还原型谷胱甘肽的含量显著增加,与对照组比较[分别为(1281.5±74.0)、(1178.9±22.0)μg/g]具有极显著意义(P<0.01)。
体外试验结果表明:草甘膦在0.00000001 - 0.0001 mol/L浓度范围内对细胞色素P(450)无明显影响,但能显著抑制脂质过氧化作用,在0.0000001 - 0.0001 mol/L时可增加还原型谷胱甘肽的含量,且呈明显剂量效应关系。
邬惠琼et al.,除草剂草甘膦对大鼠肝微粒体酶及脂质过氧化作用的影响。
同济医科大学学报,1996(5)
http://www.cnki.com.cn/Article/CJFDTotal-TJYX605.010.htm
4-3 东南大学王非2008年11月硕士论文结论:“农达在60mg/L~180mg/L范围内,能引起L-02肝细胞存活率下降,细胞膜通透性增加,抑制细胞离子转运,诱发DNA损伤,线粒体膜电位降低,Cyt C、AIF等凋亡因子泄漏,使细胞产生凋亡和坏死,对肝细胞具有明显的损伤作用;其损伤的作用机制可能与农达导致肝细胞氧化损伤、线粒体崩溃等途径有关。”
证据15(2008年11月):东南大学王非硕士论文《农达(41%草甘膦)对人L-02肝细胞损伤的研究》确认:
体外试验和体内试验都已证明,肝脏(肝细胞)是草甘膦主要的靶器官之一。 肝脏作为体内最大的脏器,具有特殊的生理生化功能和独特解剖结构和特征。肝脏易成为外源性化合物产生的毒作用靶器官。外源性化学物质经过各种途径进入机体后,均可通过血液循环达到肝脏,特别是经消化道吸收的外源性化学物。外源性化学物在肝脏内进行生物转化,在一定条件下,易对肝细胞产生损害作用[10]。
国内外对于农达和草甘膦对机体产生的影响的研究,主要集中在其产生的肝、肾损害。有学者研究表明,经草甘膦亚慢性处理的成年Wistar大鼠出现肝细胞内酶ALT、AST的泄漏,说明肝细胞出现不可逆的损伤,草甘膦处理组肝枯佛细胞增多[11]。草甘膦孕期暴露,导致母鼠增重比对照组少。肝重小于对照组:母子肝脂质过氧化物均高于对照组。草甘膦暴露和肝代谢导致MDA过表达和氧化应激,造成ROS过量,过量的ROS通过脂质、蛋白质、DNA的氧化损伤影响细胞完整性,改变基因功能调节影响发育、分化和衰老[12]。研究草甘膦对大鼠微粒体细胞色素p450基因表达的影响,结果显示草甘膦二组CYP281 mRNA水平增加62%,草甘膦一组CYP281 mRNA水平增加36%,肾脏CYP281 mRNA水平显著降低。Peixoto F等研究农达和草甘膦对线粒体氧化磷酸化影响,结果表明农达刺激琥珀酸盐支持的呼吸作用,同时跨膜电位消失,15mM农达抑制3期呼吸作用达40%,线粒体在等渗的蔗糖基质中肿胀度表明非特异的线粒体膜通透性增加[14]。研究大鼠肝线粒体的生物能量机能研究农达和他的主要成分草甘膦的潜在毒性,抑制呼吸作用3期[14],草甘膦降低肝CYTP450水平,和单氧合酶(monooxygenase)活性[16]。电镜观察鲤鱼暴露于农达的结果表明,除草剂引起了其肝细胞髓样变,线粒体肿胀,和线粒体内膜消失[17]。这些研究结果表明草甘膦暴露对肝脏功能和结构均产生影响。
以农达为代表的草甘膦类农药产品用量大,范围广,急性毒性低。正是这个原因,人们更容易忽略其长期毒效应。现有的国内外研究主要集中在草甘膦类农药可能对多种生物机体体内实验中产生的肝脏毒性、生殖毒性、遗传毒性等等,少有研究其体外实验中肝脏及其他系统的代谢、功能和细胞增生影响的机制和途径,以及各个系统对农达和草甘膦的敏感性。肝脏是农达等草甘膦农药的主要靶器官之一,是为更好的了解农达对肝细胞产生的损害及其机制,本实验选取农达为受试物,L.02人类肝细胞为受试对象,系统的研究农达在体外试验中对肝细胞产生的损伤及其机制,期望能确定肝损伤产生的途径和机制,从而更好的为人
类健康服务。
方法: 体外试验(in vitro test)以L-02肝细胞为受试细胞,通过MTT法检测不同浓度的农达对L-02肝细胞存活率的影响,选择细胞存活率为20%-80%的浓度进行后续实验。设置5个农达处理组,60mg/L、90mg/L、120mg/L、150mg/L、180mg/L和1个阴性对照组(PBS),农达处理细胞时间为24h。L-02肝细胞的形态学改变采用姬母萨染色法在光镜下观察结合透射电镜观察;农达对L-02肝细胞膜通透性影响和细胞毒性作用采用谷草转氨酶(AST)、谷丙转氨酶(ALT)活性水平结合台盼蓝拒染法来评价;农达诱导L-02肝细胞氧化损伤程度选用超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)含量等指标评价;用线粒体跨膜电位(△Ψm)检测细胞线粒体损伤;用DNA条带(DNA-Ladder)检测肝细胞DNA损伤;以AnnexinV-FITC/PI复染法测定细胞发生凋亡和坏死的情况;Western Blotting检测对照组与90mg/L组细胞色素C(Cyt C)和凋亡诱导因子(AIF)表达水平。
结果:
1.在60~180mg/L的处理浓度范围内,能明显引起L-02肝细胞存活率的降低(P<0.05),处理浓度和细胞存活率之间存在负相关(r=-0.974)。
2.在光镜下观察姬母萨染色L-02肝细胞爬片,观察到各农达处理组L-02肝细胞皱缩或肿大,形态由瓦片状收缩为圆形,细胞间隙扩大,细胞破裂,染色质浓缩,贴壁细胞密度和数量减少。电镜下观察,可发现处理组细胞出现表面微绒毛消失,细胞膜结构不完整,细胞核碎裂或肿胀,线粒体空泡样变等细胞凋亡或坏死的表现。
3.农达处理L-02肝细胞,其活细胞台盼兰蓝染比例升高(P<0.05);细胞培养上清液中ALT活性增加(P<0.05);从90mg/L组开始AST活性增加(P<0.05);农达导致处理组细胞内MDA的含量增加,SOD活性减弱,GSH含量减少(P<0.05);农达导致120~180mg/L组细胞Na~+-K~+ ATP酶活性降低(P<0.05)。
4.农达处理能诱导细胞DNA链断裂,处理浓度在150mg/L、180mg/L,DNA受损程度严重;90mg/L组Cyt C和AIF表达水平高于对照组(P<0.05);90mg/L组开始用农达处理的L-02细胞线粒体膜电位明显降低(P<0.05);农达能明显诱导处理组肝L-02细胞发生凋亡和坏死(P<0.05),随着处理农度的增高,细胞凋亡和坏死的比例增高,但是在180mg/L组凋亡比例下降。
结论: 农达在60mg/L~180mg/L范围内,能引起L-02肝细胞存活率下降,细胞膜通透性增加,抑制细胞离子转运,诱发DNA损伤,线粒体膜电位降低,Cyt C、AIF等凋亡因子泄漏,使细胞产生凋亡和坏死,对肝细胞具有明显的损伤作用;其损伤的作用机制可能与农达导致肝细胞氧化损伤、线粒体崩溃等途径有关。
王非,农达(41%草甘膦)对人L-02肝细胞损伤的研究,
中南大学(硕士论文),2008年11月
http://www.cdmd.cnki.com.cn/Article/CDMD-10533-2008165795.htm
4-4 滨州学院生命科学系、滨州市食品安全重点实验室学者2011年研究揭示:草甘膦对鲫鱼“半数致死量为128.11 mg/L”,随草甘膦浓度的增加“肝细胞内膜系统中线粒体肿胀及空泡化、内质网空泡化、异噬型溶酶体增多”。
证据16(2011年3月):《滨州学院学报》发表张彬彬《草甘膦对鲫鱼肝脏内膜系统和乙酰胆碱酯酶的影响》确认:
通过急性中毒试验,用SPSS数据处理软件计算24h急性中毒试验的半数致死量为128.11 mg/L,95%置信区间为78.12 - 210.09 mg/L;48h中毒试验的半数致死量为48.96 mg/L,95%的置信区间是30.52 - 53.74 mg/L,安全浓度为1.50 mg/L.。
以急性试验为依据,根据24h内鲫鱼不出现死亡和明显异常为标准,确定最高染毒浓度为5.12 mg/L,以此为标准,按1/2浓度梯度递减,分别为2.56、1.28、0.64、0.32、0.16 mg/L共5个浓度组(1 - 5组),每个浓度设2个平行。另设一不加草甘膦的对照组(CK)。每组均放15尾鲫鱼,每24h更换一次处理液。在24、48、96h从每组取出4条鲫鱼,取其肝脏。肝脏匀浆的制备和AChE活力的测定均按照南京建成生物工程研究所提供的测试盒进行制备和测定。
结果表明,随浓度的增加,肝细胞内膜系统中线粒体肿胀及空泡化、内质网空泡化、异噬型溶酶体增多.不同浓度的草甘膦处理液对泥鳅肝脏中AChE均起抑制作用。
通过实验结果分析可以看出:鲫鱼AChE活性随同一浓度草甘膦污染液暴 露时间的延长,呈递减变化,表现为抑制效应;同时在同一时间段鲫鱼肝脏AChE活性呈现先下降后上升的趋势,这与翟中和等有关理论相符合,即当细胞长期暴 露在某种形式的刺激下,细胞对刺激的反应将会降低,表现为对外界刺激的适应[10]。
从鲫鱼AChE酶活性和草甘膦污染液浓度的变化趋势可以看出:AChE酶活性与草甘膦污染液浓度之间存在一定的剂量一效应和时间一效应关系,AChE可 以作为监测环境污染的生物标志物,在一定条件下用于水体污染的生物检测.
由此看出鲫鱼的AChE活性变化和草甘膦处理液浓度以及暴露时间存在一 定的剂量一时间一效应关系.草甘膦在粮食作物中的残留及人体的蓄积都有报道,但草甘膦对水生生物的影响研究不多。本研究为环境保护、渔业生产及合理 使用除草剂,提供了一定的参考依据。
张彬彬,草甘膦对鲫鱼肝脏内膜系统和乙酰胆碱酯酶的影响。
滨州学院学报,2011,27(3) 93-96.
http://www.cnki.com.cn/Article/CJFDTOTAL-BZSX201103019.htm
4-5上海市水产研究所、上海市水产技术推广站2015年确认:“组织学试验表明,草甘膦对中华绒螯蟹幼蟹的肝胰腺有明显损伤。...经草甘膦处理10 d后... 肝小管内膜有脱落现象。... 经草甘膦处理28 d后,肝小管已完全丧失正常形态,其内腔变成空管状,内壁被完全破坏,游离于管腔中。肝胰腺细胞高度明显变低,已经失去柱状上皮细胞的正常形态,B细胞进一步增生,占满整个肝小管,R细胞和B细胞几乎无法发现。部分肝小管已经出现破裂。”
证据17(2015年5月):《水产科技情报》发表上海市水产研究所、上海市水产技术推广站史建华、刘智俊、陆锦天、李住、杨茜获“上海市中华绒螯蟹产业技术体系“上海河口地区大规格成蟹生态养成模式与技术研究”资助《草甘膦对中华绒螯蟹幼蟹的毒性影响》确认:
通过48 h半静水法测定草甘膦对中华绒螯蟹的半致死浓度(LC50)和安全浓度(SC),并据此结果设定28 d慢性试验浓度,测定中华绒螯蟹的死亡率、蜕壳率和平均蜕壳天数,以及肝胰腺组织学变化。
组织学试验表明,草甘膦对中华绒螯蟹幼蟹的肝胰腺有明显损伤。随着浸泡时间延长,损伤明显加重。图1—1为正常中华绒螯蟹的肝胰腺,肝小管横截面清晰,呈现四角星形,可明显区分3种类型的肝胰腺细胞:全细胞嗜碱性的F细胞、具有顶泡结构的B细胞、充满脂滴的R细胞,各细胞边界清楚。
经草甘膦处理10 d后,R细胞细胞核嗜碱性加强,B细胞向肝小管内突出,肝小管内膜有脱落现象(见图1—2)。
经草甘膦处理20 d后,B细胞呈病理性增生,占据肝小管大部分位置,而R细胞间的脂滴消失,仅剩下细胞核(见图1—3)。细胞间边界模糊,难以分辨,肝小管膨大,四角星形消失,部分肝小管结构消失,细胞降解(图1—3中箭头所指)。
经草甘膦处理28 d后,肝小管已完全丧失正常形态,其内腔变成空管状,内壁被完全破坏,游离于管腔中(见图1—4)。肝胰腺细胞高度明显变低,已经失去柱状上皮细胞的正常形态,B细胞进一步增生,占满整个肝小管,R细胞和B细胞几乎无法发现。部分肝小管已经出现破裂(图1—4箭头所指)。
讨论
草甘膦对非靶标生物也有一定的毒性[7]。本研究中,草甘膦12、24、36、48 h的半致死浓度分别为18.91、16.67、13.99、12.09 mg/L,根据现行农药对水生生物毒性的分级标准,对中华绒螯蟹的毒性为低毒[8]。
研究表明,草甘膦水剂对克氏原螯虾的急性毒性试验中,48 h的半致死浓度为4060 mg/L,同样为低毒[9]。
在以往的研究中,草甘膦的安全浓度推算都是基于急性试验,对慢性试验的研究较少。本研究中,低浓度的草甘膦农药虽然不会立即造成中华绒螯蟹大规模死亡,但长期低剂量暴露依然会对中华绒螯蟹造成不可逆的伤害。
然而草甘膦对鱼类的毒性则完全不同,草甘膦对草鱼、鲢鱼和鲫鱼的96 h半致死浓度分别为0.2518、0.2588、0.2599 mg/L,属于高毒农药L10I;草甘膦对泥鳅等无鳞鱼类的毒性更大,对泥鳅体内淋巴细胞的分化有一定影响,过量使用甚至会导致水田中泥鳅绝迹[11]。
除此之外,草甘膦对环境中的其它非靶标生物,如软体动物[12]、土壤生物[13]、浮游动物[14]等均有一定毒性作用。因此,如果在稻蟹共作的池塘内同时混养经济鱼类,草甘膦对鱼类的生存有极大的威胁,同时也会对整个种养生态系统造成破坏。
草甘膦的作用部位和机理是植物所特有的,因此草甘膦被认为属于低风险的除草剂。但是,即使在应用过程中将其控制在安全浓度以内,也不能保证该药剂对生态系统中其它生物是安全的,并且草甘膦的蓄积作用可能会带来一系列后续的食品安全问题。因此在稻蟹共养的生产模式中,还是需要尽量避免草甘膦的使用。
史建华et al.,草甘膦对中华绒螯蟹幼蟹的毒性影响,水产科技情报,2015, 42(5)
http://d.wanfangdata.com.cn/periodical/sckjqb201505005
4-6 南京农业大学动物科技学院学者2016年研究证实:“草甘膦除草剂处理组大鼠肝组织均表现结构紊乱。...肝脏,脾脏和肾脏重量也显著降低 ...草甘膦除草剂(GLP)可引起大鼠肝细胞发生脂质过氧化反应,抗氧化酶被大量消耗,肝组织中脂质过氧化程度增强,自由基的生成与清除这一动态平衡受到破坏,最终导致机体抗氧化能力减弱,引起肝细胞氧化损伤”。
证据18(2016年):《中国畜牧兽医学会家畜环境卫生学分会2016学术年会论文集》发布南京农业大学动物科技学院唐娟、戴鹏远、李若楠、胡平、李春梅获“江苏省自然基金面上项目(BK20131315)”资助《草甘膦对大鼠肝脏炎症和脂质过氧化相关基因表达的影响》确认:
方法:实验选取32只8周龄SD雄性大鼠,随机分成4组,分别为对照组和 5、50、500 mg²kg-1 体重草甘膦除草剂(GLP)处理组,连续灌胃 5 周。最后一次灌胃 24 小时后宰杀大鼠并采集各脏器称重。......
结果:草甘膦除草剂(GLP)处理组大鼠肝组织均表现结构紊乱.在500mg·kg-1 草甘膦除草剂(GLP)处理组内大鼠体重,体增重,平均日采食量,平均日增重和料重比均显著降低(P<0.05);肝脏,脾脏和肾脏重量也显著降低(P<0.05),血清中ALT、AST、IL-1β水平显著升高(P<0.05),同时血清和肝组织中超氧化物歧化酶(SOD)水平显著降低,血清中H2O2和CAT显著上升。
RT-PCR结果表明,IL-1α,IL-1β在所有处理组中表达均显著上升,在50,500mg·kg-1组中肝组织中中IL-6、MAPK3、SIRT1和脂质相关基因PPAR、SREBP、SCR-1表达水平显著升高(P<0.05),而Keap1和DGAT表达水平分别在50mg·kg-1和500mg·kg-1处理组中显著升高。...
讨论与结论:
谷丙转氨酶(GPT)和谷草转氨酶(GOT)是肝细胞损伤的敏感指标,均能反映肝细胞的损伤程度[2]。MDA 作为脂质过氧化降解的产物之一,可以反映体内脂质过氧化的程度及细胞受自由基攻击的程度[3];超氧化物歧化酶(SOD)作为体内清除活性氧(ROS)自由基中超氧阴离子的专一性抗氧化酶,对机体的氧化与抗氧化平衡起着至关重要的作用[4]。我们的研究结果提示草甘膦除草剂(GLP)可引起大鼠肝细胞发生脂质过氧化反应,抗氧化酶被大量消耗,肝组织中脂质过氧化程度增强,自由基的生成与清除这一动态平衡受到破坏,最终导致机体抗氧化能力减弱,引起肝细胞氧化损伤。
唐娟et al., 草甘膦对大鼠肝脏炎症和脂质过氧化相关基因表达的影响,中国畜牧兽医学会家畜环境卫生学分会2016学术年会论文集,2016
http://cpfd.cnki.com.cn/Article/CPFDTOTAL-XMWS201608001027.htm
4-7 南京农业大学无锡渔业学院、中国水产科学研究院学者2018年研究确认:“草甘膦暴露引起罗非鱼出现不同程度的精神萎靡,排泄物增加,肝指数显著升高。高浓度草甘膦组中,血清白蛋白(ALB)、总蛋白(TP)、还原性谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)均显著降低,血清转氨酶活性显著增加,肝脏病理出现显著的病理改变,与对照组比较具有统计学差异”。
证据19(2018年):《2018年中国水产学会学术年会论文摘要集》发表南京农业大学无锡渔业学院、中国水产科学研究院淡水渔业研究中心鱼类免疫药理国际联合实验室郑涛、贾睿、杜金梁、曹丽萍、Galina Jeney、徐跑、殷国俊《草甘膦致罗非鱼慢性肝毒性研究》确认:
方法:将罗非鱼暴露于不同浓度的草甘膦(0、0.2、0.8、2、16mg/l)中,投喂80天,然后采集血液和肝组织,检测肝损伤指标。
结果显示,草甘膦暴露引起罗非鱼出现不同程度的精神萎靡,排泄物增加,肝指数显著升高。高浓度草甘膦组中,血清白蛋白(ALB)、总蛋白(TP)、还原性谷胱甘肽(GSH)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)均显著降低,血清转氨酶活性显著增加,肝脏病理出现显著的病理改变,与对照组比较具有统计学差异。
该研究将丰富草甘膦毒理学研究数据,同时为草甘膦规范使用提供理论基础。
郑涛et al.,草甘膦致罗非鱼慢性肝毒性研究,
2018年中国水产学会学术年会论文摘要集 2018年
http://cpfd.cnki.com.cn/Article/CPFDTOTAL-OGSB201811001042.htm
5、南京医科大学公共卫生学院、江苏省疾病预防控制中心职业病防治所、东南大学公共卫生学院、昆山市疾病预防控制中心学者2015、2016、2017与2019年研究证实:“草甘膦接触工人的肝脏检查指标出现较高的异常率,草甘膦的暴露可能对长期接触作业人员产生一定的肝损伤”。
证据20(2015年5月):《中国工业医学杂志》发表扬州市疾病预防控制中心、江苏省疾病预防控制中心毛一扬、孙兰芳、蔡翔、窦建瑞、朱宝立、张锋获“江苏省预防医学科研课题立项项目(Y2012054) ; 国家卫生标准项目(20140701)”《草甘膦对工人血清生化指标的影响》确认:
草甘膦是一种常见的除草剂,我国为草甘膦生产和使用的大国,全球有近一半的草甘膦在中国生产,接触人数众多。目前与草甘膦毒性方面有关的研究主要为动物实验且大都集中在上世纪 90 年代。由于缺少单一接触的人群和接触者都为小剂量短时间接触,所以目前尚缺乏草甘膦对人体的毒性的专一研究。2008 年,巴西对草甘膦重新进行评估,官方建议将其毒性等级从第四级(微毒)提高到一级(剧毒)。...
选择草甘膦生产企业接触草甘膦原药的作业人员59人为接触组,男46人、女13人,平均年龄 ( 31. 22±8. 59) ( 20 ~ 46) 岁,平均工龄 ( 4. 56±2. 16) ( 1~ 18) 年。随机选取同地域饮食、生活习惯近似的非职业接触工作人员42人作为对照组,男29人、女13人,平均年龄 ( 33. 92 ± 8. 42) ( 22 ~ 50) 岁,平均工龄 ( 4. 05±1. 76) ( 1 ~ 23) 年。所调查对象均为50 岁以下未患有肝、肾、心脑等疾病,无长期服药史工人。分别测定并比较两组人员血清生化指标的差异。
结果显示,接触组血清中的碱性磷酸酶、肌酸激酶、肌酸激酶同工酶、总蛋白、白蛋白、尿素氮和总胆固醇与对照组比较,差异有统计学意义(P0.05);两组血清中的碱性磷酸酶、肌酸激酶、肌酸激酶同工酶、总蛋白、白蛋白、尿素氮和总胆固醇的异常率比较,差异无统计学意义(P0.05),其余生化指标均无统计学意义(P0.05)。提示草甘膦作业环境可能对工人血清生化指标含量有一定影响。
讨论
越来越多的研究表明,草甘膦对不同的生物及其生育期具有不同程度的影响[3~8]。
徐辉[9]对 60 例草甘膦中毒患者的临床资料进行回顾性分析,发现有 20 例患者出现肝功能异常、2 例患者出现肾功能异常,肝、肾功能指标均明显高于正常参考值,主要表现为 ALT、AST、TBIL、BUN、Cr 的升高。
许明正等[10]对 13 例患者进行调查,发现其血 ChE 活性及肾功能均正常,但有 5 例 AST、ALP 轻度增高。也有部分中毒患者出现 ALT 和 ChE 升 高[11]。
有学者研究了草甘膦作用下AChE、LDH、AST、ALT、ALP、ACP 的活性以及血清蛋白电泳,结果显示草甘膦对于除了 ACP 以外的酶均有作用[12]。
Zouaoui K 等[13]搜集了 13 例草甘膦急性中毒患者,对于其中有入院记录的 10 例病人进行调查,发现临床表现为呼吸窘迫、心律失 常、肾 功 能 损 伤、肝毒性和意识的丧失。
张彬彬[14]根据透射电镜观察草甘膦处理过的鲫鱼肝细胞,也证实了高浓度组鲫鱼肝细胞中出现了一系列的亚细胞结构形态病变: 线粒体肿胀、空泡以及内质网空泡化。这种结构改变大多是细胞不可恢复性损伤的标志,提示活体内肝细胞死亡或坏死的出现,从而扰乱生物体正常的生理机能,产生显著的中毒症状。
本研究结果显示,草甘膦接触组的 ALP、CK、CK- MB、TP、ALB 均高于对照组,可能是由于接触组较长期接触高纯度的草甘膦导致肝脏部分功能出现了某些应激反应。但两组的异常率之间没有显著性差别,且大部分结果均在正常范围内,可能与接触时间和剂量没有达到人体出现效应的阈剂量有关,目前草甘膦对人体的剂量-效应主要体现在某些功能指标的量的变化。接触组的 BUN、CHOL 低于对照组,一方面可能与肝、肾功能受影响造成营养物质不能正常吸收有关,另一方面可能与样本量受限有关。
草甘膦对暴露人群肝功能的影响可能与肝脏代谢和分解外来化合物的生理生化功能有关,外源性化合物在肝脏内进行生物转化,易于对肝脏产生损害。目前普遍认为草甘膦是在肝细胞线粒体中使氧化磷酸化作用受阻,二磷酸腺苷( ADP) 不能转化为能量三磷酸腺苷 ( ATP) ,细胞缺少能量后发生坏死,从而引起组织损害及衰竭。
草甘膦使用范围广泛,在土壤、水和食物中都有残留,可通过食物链对人体造成威胁,故其对人类是否具有潜在的毒性值得关注。鉴于草甘膦的巨大市场需求潜力,国内有很多家企业扩建新建生产装置,接触草甘膦的工人大大增加;在使用过程中,许多农场等地接触人员也在不断增加。
但一方面国内外对草甘膦的损伤机制还不是很明确; 另一方面草甘膦的毒性资料主要来自动物实验,且研究较为分散和稀少,缺少关于草甘膦对人群健康危害的资料; 目前尚未见其对单一直接接触人群的相关调查资料,也没有其损伤途径和人体的敏感生物标志物的研究。因此有必要对直接单一长期接触人群进行监测,为草甘膦的毒性资料提供有力的参考依据,对控制和降低草甘膦可能存在的远期危害起到积极作用。
毛一扬et al.,草甘膦对工人血清生化指标的影响,中国工业医学杂志,2015(5)
http://www.cnki.com.cn/Article/CJFDTotal-SOLE201505019.htm
证据21(2016年4月):《环境与职业医学》发表南京医科大学公共卫生学院、江苏省疾病预防控制中心职业病防治所、东南大学公共卫生学院潘丽萍、张锋、刘庆东、赵秋妮、丁恩民、王博深、朱宝立获“国家卫生标准项目(编号 :20140701);江苏省医学领军人才项目(编号 :LJ201130)”资助《职业接触草甘膦工人肝脏指标分析》确认:
方法:采用整群抽样的方法抽取4家草甘膦生产企业进行职业卫生调查和作业场所空气中草甘膦监测。选取草甘膦生产一线工人为接触组(345人),选取同厂不接触草甘膦及其他有毒有害因素的工人为对照组(345人)。对工人进行问卷调查以及健康检查。
结果:工厂作业环境空气中草甘膦质量浓度监测以干燥和包装岗位较高,干燥岗位最高达到94.59 mg/m3,包装岗位最高达到20.68~26.43 mg/m3。接触组胆碱酯酶(Ch E)、丙氨酸转氨酶(ALT)、总胆红素(TBIL)异常率(10.4%、12.5%、11.9%)均高于对照组(4.3%、7.8%、6.1%)(P=0.002、P=0.044、P=0.008)。草甘膦接触工人中,高工龄组肝脏B超异常率(39.6%)高于低工龄组(27.0%)(P=0.014);男工肝脏B超异常率(36.5%)、ALT异常率(16.6%)均高于女工(23.1%、2.9%)(P=0.014,P=0.000),女工Ch E异常率(19.2%)高于男工(6.6%)(P=0.000)。
结论:草甘膦可能会对接触工人的肝脏造成损伤。... 本次研究发现相比于对照人群,草甘膦接触工人的肝脏检查指标出现较高的异常率,草甘膦的暴露可能对长期接触作业人员产生一定的肝损伤,但需要进行更大样本、更全面的流行病学调查研究。
潘丽萍et al.,职业接触草甘膦工人肝脏指标分析[J].环境与职业医学,2016,33(4):380-384.
http://www.cnki.com.cn/Article/CJFDTOTAL-LDYX201604019.htm
证据22(2017年3月):《工业卫生与职业病》发表扬州市疾病预防控制中心、江苏省疾病预防控制中心窦建瑞、毛一扬、孙兰芳、蔡翔、朱宝立、张锋获“江苏省预防医学科研课题立项项目(Y2012054);国家卫生标准项目(20140701)”《草甘膦对职业人群健康状况的影响》确认:
我们此次以草甘膦原药生产工人(单一接触高浓度草甘膦的职业人群)为调查对象,进行人群健康影响的调查,为其职业卫生防护提供依据。
方法:选择单一接触草甘膦原药的男性作业工人27名为接触组,同地域非职业接触工作人员27人作为对照组,进行问卷调查和职业健康检查。
结果:与对照组比较,接触组工人平均血红蛋白浓度明显降低,差异有统计学意义(Z=2.77,P0.01);红细胞分布宽度CV(Z=1.99,P=0.04)、平均血小板体积(Z=2.33,P=0.02)、血小板分布宽度(Z=2.03,P=0.04)、大型血小板比率(Z=2.28,P=0.02)明显升高,差异有统计学意义;与对照组比较,接触组工人直接胆红素(Z=2.91,P0.01)、白球比(Z=2.06,P=0.04)、天冬氨酸转氨酶(Z=2.35,P=0.02)、葡萄糖(Z=2.31,P=0.02)明显升高,差异有统计学意义;与对照组比较,接触组工人肌酐明显降低,差异有统计学意义(Z=2.36,P=0.02);其余指标均无统计学意义(P0.05)。
结论:草甘膦可能一定程度上影响着机体的造血功能,长期接触有可能导致贫血。草甘膦可能会对肝细胞产生损害作用。
讨论:
人的红细胞死亡后变成间接胆红素,经肝脏转化为直接胆红素,组成胆汁,排入胆道。若肝细胞受损,胆红素不能正常转化为胆汁,或是胆汁排泄受阻,都会引起直接胆红素偏高。与对照组比较,草甘膦接触组工人直接胆红素明显升高。说明接触组肝细胞受损或者出现了梗阻现象。
目前普遍认为草甘膦是在肝细胞线粒体中氧化磷酸化作用受阻,二磷酸腺苷(ADP)不能转化为三磷酸腺苷(ATP),细胞缺少能量后发生坏死,从而引起组织损害及衰竭。
本次调查结果显示,接触组工人生化指标中的白球比、天冬氨酸转氨酶和葡萄糖的值明显比正常组高,这与徐辉等[2,10-11]报道的一致,说明长期接触草甘膦可能会导致肝脏的损伤,进而出现一系列的病理反应。而与对照组比较,接触组工人肌酐明显降低提示可能是肾功能受损所致。
窦建瑞et al.,草甘膦对职业人群健康状况的影响,工业卫生与职业病,2017(3)
http://www.cnki.com.cn/Article/CJFDTotal-GYWZ201703004.htm
证据23(2019年5月):《职业卫生与应急救援》发表昆山市疾病预防控制中心、江苏省疾病预防控制中心宋仙平、蔡文妍、刘炘、张峰、朱宝立获“江苏省医学创新团队项目(CXTDA2017029)”资助《草甘膦生产企业职业病危害调查》确认:
草甘膦自20世纪60年代于美国孟山都公司生产推广,现已成为全球产量最大的农药原药除草剂品种。全球草甘膦的市场年需求量达到120万t左右,国内草甘膦的市场年需求量为15万t左右[4]。我国草甘膦生产厂商30余家,数量众多,草甘膦生产运输过程中职业接触人群也较多。
以江苏某化工企业作为研究对象。该企业目前草甘膦年产量为 7 万 t,生产工艺为甘氨酸法。车间实行密闭化生产,除包装外均是巡检作业,包装岗位作业时间为 8 h/d,巡检作业时间约 3 h/d,实行四班三运行制。包装工人佩戴普通纱布口罩、乳胶手套,需手动更换包装袋、手动投料制剂。选择草甘膦生产线上的一线工人作为暴露人群,企业内部不接触草甘膦生产危害因素的人员 (主要为办公室行政岗位、销售人员、物管内勤人员、保安等)为对照人群,以了解草甘膦生产过程中的危害因素与工人健康损伤的关系。
结果:工作场所各职业病危害因素检测结果均符合国家卫生标准的要求.烘干包装岗位草甘膦质量浓度相对较高(3.62~20.68 mg/m3)。暴露组谷丙转氨酶、尿素氮、尿酸水平高于对照组,胆碱酯酶水平低于对照组,差异具有统计学意义(P<0.05);异常率方面,只有胆碱酯酶的异常率高于对照组,差异具有统计学意义(P<0.01),而总蛋白、白球比、肌酐的平均水平差异没有统计学意义(P>0.05)。包装岗位劳动者谷丙转氨酶和胆碱酯酶水平与对照组不同;包装组的总蛋白、尿酸和胆碱酯酶的异常率高于对照组(P<0.01)。
结论:草甘膦生产车间主要的职业病危害因素有甲醛、氯甲烷、三乙胺、草甘膦、粉尘和噪声,需加强对草甘膦车间职业病危害因素的控制,改善作业环境,提高个人防护水平。
讨论:
...各车间粉尘浓度在职业接触限值范围内,但烘干包装车间粉尘浓度较高,且需要人工包装,工人需要长时间在包装机周围操作,多数工人防护意识薄弱,只佩戴普通口罩或不规范佩戴,长此以往容易引发职业健康危害。
... 健康体检结果显示草甘膦生产线一线工人 (暴露组)的谷丙转氨酶、尿素氮、尿酸水平高于不接触草甘膦的人员(对照组)(P < 0.05),可能是由于工人暴露于生产过程中的甲醛、三乙胺和草甘膦等会引起人体肝肾功能损伤的化学因素导致的。有机磷毒物进入体内后迅速与体内的胆碱酯酶结合,致使体内胆碱酯酶减少[14],一线工人的胆碱酯酶平均水平低于对照人群 (P <0.05),胆碱酯酶异常率高于对照人群(P < 0.01),表明生产线上草甘膦暴露可影响人体内胆碱酯酶的水平,该结果与张锋等的研究结果一致[15-16]。
尽管草甘膦属低毒除草剂,但研究表明草甘膦对人有肝毒性,免疫毒性、内分泌毒性甚至致癌性[17-19],草甘膦进入人体后效应器官为肝脏和肾脏[19],会对人体的肝功能、肾功能造成不同程度的损害[20],其致病机理可能是草甘膦进入肝肾细胞后发生氧化应激反应,致使线粒体损伤进而导致细胞凋亡坏死[21]。
国内外至今尚无工作场所草甘膦职业接触限值,我国规定生活饮用水中草甘膦限值为0.7 mg/L。烘干包装岗位草甘膦的检出水平显著高于其他岗位,部分工人无合理有效的个人防护,包装组的谷丙转氨酶和胆碱酯酶平均水平与对照组存在差异(P < 0.05),总蛋白、尿酸、胆碱酯酶异常率高于对照组(P < 0.01),表明该工作场所中烘干包装岗位草甘膦浓度或接触时间(8 h/d)可能对接触人员的健康产生影响。
宋仙平et al.,草甘膦生产企业职业病危害调查,职业卫生与应急救援,2019, 37(5)
https://d.wanfangdata.com.cn/periodical/zywsyyjjy201905019
6、中国临床医生抢救草甘膦中毒患者结论:“肝脏系统方面,患者可能会出现肝功能不正常的情况”、“60例草甘膦中毒患者中,20例肝功能异常,占33.3%”。
证据24(2020年):南京市胸科医院董静主任医师视频《草甘膦中毒对人体的危害程度有多大》确认:
“若患者草甘膦中毒的情况比较严重,则患者的各个系统均可能出现严重反应。消化系统方面,患者可能会出现呕吐的情况;神经系统方面,患者可能会出现头痛、头晕的情况;肝脏系统方面,患者可能会出现肝功能不正常的情况。”
南京市胸科医院董静主任医师视频:草甘膦中毒对人体的危害程度有多大
https://www.jiankang.com/myft/92358.shtml
https://vde.jiankang.com/mingyi/dongjing1798/3.mp4
证据25(2009年8月):《中华劳动卫生职业病杂志》发表四川省人民医院急救中心徐辉《不同除草剂口服中毒治疗效果的观察》确认:
我们收集总结了2004至2007年我院急救中心收治的除草剂草甘膦、百草枯中毒患者 的临床资料,对其进行分析,以期加深对除草剂中毒的认识。
结果
1.临床症状:
86例百草枯中毒者自诉口腔、胸骨后或上腹疼痛,随病程的延长,服药量较大者(>20ml)均出现进行性加重的呼吸困难和低氧血症,65例患者伴有严重的肝功能损害,表现为黄疸、腹水;48例伴肾功能损害,表现为少尿或无尿。
60例草甘膦中毒患者无明显的口腔和上消化道灼伤症状,服毒后表现为头昏、乏力,少数患者有腹痛症状。1周内,20例草甘膦中毒患者肝功能转氨酶和黄疸指数轻度升高,但治疗后,恢复较快。病程中,所有患者均未发生急性呼吸衰竭。
2.肝、肾功能的比较:
86例百草枯中毒患者中,65例肝功能异常,占75.6%;48例肾功能异常,占55.8%;
60例草甘膦中毒患者中,20例肝功能异常,占33.3%;2例肾功能异常,占3.3%。
百草枯中毒和草甘膦中毒的肝功能异常率比较,差异有统计学意义(x2=25.93,P<0.05),肾功能异常率比较,差异有统计学意义(x2=43.23,P<0.05);百草枯中毒患者的丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)和总胆红素(TBI)、尿素氮、肌酐均明显高于草甘膦中毒者及正常参考值,差异均有统计学意义(p<0.05),见表1。
治疗效果比较:
86例百草枯中毒患者,平均住院时间15d,死亡76例,病死率达88.4%。其中,因ARDS死亡者48例,占总死亡数的56%,因肝肾衰竭死亡者28例,占32.6%。入院后第1周,死亡34例;入院后第2周,死亡23例,前2周共计死亡57例,病死率为66.3%。1个月内累计死亡73例,病死率84.9%。
60例草甘膦中毒患者住院时间7d,经保肝、对症等治疗,所有患者均好转或痊愈出院,无死亡病例。随访1个月后出院患者的病情变化,百草枯中毒者死亡3例,草甘膦中毒无死亡者。
讨论:
20%的百草枯10ml即可致人死亡,百草枯中毒症状除常见的口腔、舌、食管的溃烂外,尚可迅速发生咳嗽、咳痰、呼吸困难,严重者因ARDS死亡。部分患者可有心肌损害,而许多未出现呼吸系统症状的患者,随病程的发展,可发生进行性加重的肝肾功能损害,虽积极抢救,但百草枯中毒死亡率仍高达60%~80%,幸存者也常遗留严重的肺纤维化,预后不 良。
草甘膦属低毒除草剂,在动物体内不蓄积,在试验条件下对动物未见致畸、致突变、致癌作用。对鱼和水生生物毒性较低;对蜜蜂和鸟类无毒害;对天敌及有益生物较安全[1]。
人误服草甘膦后,可刺激口腔黏膜、咽喉,进入人体后,一般症状较轻,部分患者可发生低血压、头昏、乏力和出汗,肝、肾损害一般较轻,常可自行恢复。经口服中毒的严重病例,易发生吸人性肺炎及(或)肺水肿,严重者可因呼吸衰竭致死。草甘膦中毒的治疗包括清洗排毒,对症支持治疗,目前尚无满意的特效解毒药剂。该除草剂中毒虽然有一定的致死率,但早期施以正确的治疗,可明显改善其预后[2-3]。
徐辉,不同除草剂口服中毒治疗效果的观察,中华劳动卫生职业病杂志,2009,27(8)
https://d.wanfangdata.com.cn/periodical/zhldwszyb200908016
7、《临床胃肠病学和肝病学》2019年3月加利福尼亚大学圣地亚哥分校家庭医学与公共卫生系、胃肠病学系医学系、医学系非酒精脂肪肝疾病(NAFLD)研究中心、法国里昂大学里昂市民医院医学团队研究确认:“与没有炎性亚型非酒精性脂肪性肝病(NASH)的患者相比,患有炎性亚型非酒精性脂肪性肝病(NASH)的患者的草甘膦排泄量显着更高 ... 随着纤维化阶段的增加,草甘膦暴露量的剂量依赖性显着增加。”
证据26(2019年3月):《临床胃肠病学和肝病学》(Clin Gastroenterol Hepatol.)发表加利福尼亚大学圣地亚哥分校家庭医学与公共卫生系、胃肠病学系医学系、医学系非酒精脂肪肝疾病(NAFLD)研究中心、法国里昂大学里昂市民医院Paul J Millset al.《草甘膦的排泄与脂肪性肝病患者的脂肪性肝炎和晚期肝纤维化有关》确认:
引言
非酒精性脂肪性肝病(NAFLD)是目前在发达国家中最常见的慢性肝病[1],非炎性亚型非酒精性脂肪性肝病(NASH)患者被认为具有发展为肝硬化和肝细胞癌较高的纤维化进展的风险。
暴露于杀虫剂和除草剂可能是导致非酒精性脂肪性肝病(NAFLD)病理生理的环境因素之一[2]。草甘膦是草甘膦除草剂农达(Roundup®)中的主要除草成分,被喷洒到转基因(GM)作物和许多非转基因谷物上,在收获的这些农作物中发现[3]。
长期饲喂低剂量草甘膦的啮齿动物表现出肝毒性、肝充血、坏死和肝细胞DNA损伤的迹象[4,5,6]。本项研究在经过活检证实的非酒精性脂肪性肝病(NAFLD)患者中,对特征明确且有前瞻性的队列中的草甘膦及其主要代谢产物氨基甲基膦酸(AMPA)的排泄水平进行了研究。
方法
参与者最初是在2012年9月至2018年3月之间于加州大学圣地亚哥分校(UCSD)非酒精性脂肪性肝病(NAFLD)研究中心进行的一项大型研究的一部分。 如前所述[7],通过标准化研究访问,包括详细的医学和饮酒史以及人体测量学和体格检查,对怀疑患有非酒精性脂肪性肝病(NAFLD)并具有肝活检临床指征的患者进行了仔细评估,以评估其他原因引起的肝脂肪变性和肝病。 使用非酒精性脂肪性肝炎临床研究网络组织学评分系统进行组织学评分。 在进行统计分析之前,将病例分为确定的炎性亚型非酒精性脂肪性肝病(NASH),或非炎性亚型非酒精性脂肪性肝病(NASH)的非酒精性脂肪性肝病(NAFLD)。这项研究已由加州大学圣地亚哥分校(UCSD)机构审查委员会批准。从该项研究每位参与者获得知情了书面同意。
每位患者提供了空腹尿液样本,该样品存储在-80℃下。使用高效液相色谱法结合质谱法分析尿液样品中的草甘膦及其代谢物AMPA。使用公式[(草甘膦+ 1.5)×AMPA],我们计算了草甘膦残留量,该估算值可提供膳食摄入量和残留量的估计值。
使用了随年龄、性别和体重指数(BMI)变化的方差分析(ANOVA),,协方差分析(ANCOVA),卡方和多元通用线性模型(SPSS 24.0版软件包(IBM,Armonk,NY))。 因变量是草甘膦、代谢物AMPA和草甘膦残留量。 在p≤0.05的水平上,结果被认为具有统计学意义。 在进行统计分析之前,先对数据进行方差的正态性和均质性测试。
结果
表1列出了患者的特征。年龄和体重指数(BMI)皆与草甘膦、AMPA或草甘膦残留量无显着相关。 同样,糖尿病状态和种族/种族均与草甘膦,AMPA或草甘膦残留量无显着相关。 尿样草甘膦妇女[0.373μg/ L(SD = 0.41)] 相对于 男人[0.215μg/ L(SD = 0.17)(F = 5.18; p = 0.025)]和草甘膦残留物,妇女[0.833μg/ L(SD = 0.67)相对于男性[0.594μg/ L(SD = 0.38)(F = 4.09; p = 0.046)]比男性高。
讨论
我们报告,与没有炎性亚型非酒精性脂肪性肝病(NASH)的患者相比,患有炎性亚型非酒精性脂肪性肝病(NASH)的患者的草甘膦排泄量显着更高。此外,我们还报告,随着纤维化阶段的增加,草甘膦暴露量的剂量依赖性显着增加。
对于不在农业或园艺行业工作的个人,草甘膦暴露的主要途径是通过摄入经草甘膦除草剂农达(Roundup®)处理的转基因食品和/或非转基因作物,例如小麦和燕麦[3]。反映增加了对草甘膦的接触。
尽管这项研究有很多优势,包括使用特征明确的队列进行肝活检来诊炎性亚型非酒精性脂肪性肝病(NASH)和肝纤维化分期,但我们承认存在局限性,包括没有饮食摄入或职业方面的信息,也没有没有非酒精性脂肪性肝病(NAFLD)的患者。 我们未发现草甘膦排泄与体重指数(BMI)之间存在关联,这表明草甘膦的摄入量与总热量摄入量无关。
至于草甘膦对肝脏的潜在机制,Mesnage等人的研究(Mesnage et al., 2017)表明草甘膦的老鼠破坏了肝脏的线粒体氧化磷酸化,导致蛋白质组紊乱,反映了过氧化物酶体增殖,脂肪变性和坏死,与非酒精性脂肪性肝病(NAFLD)及其发展为炎性亚型非酒精性脂肪性肝病(NASH)[4]一致。其他研究表明草甘膦抑制脂肪酸氧化并增加脂肪和胆固醇酯,小鼠肝脏中的胆固醇水平升高,导致每克肝脏中脂质含量增加[8]。
Paul J Millset al.,Glyphosate Excretion is Associated With Steatohepatitis and Advanced Liver Fibrosis in Patients With Fatty Liver Disease.
Clin Gastroenterol Hepatol. 2020 Mar;18(3):741-743.
Paul J Millset al.,草甘膦的排泄与脂肪性肝病患者的脂肪性肝炎和晚期肝纤维化有关。
临床胃肠病学和肝病学。2020年3月;18(3):741-743.
https://pubmed.ncbi.nlm.nih.gov/30954713/
8、孟山都公司草甘膦除草剂农达制剂1988年申请“农药登记”提交的毒理学动物试验报告白纸黑字声称“草甘膦除草剂‘农达’...‘三致’试验结果表明该产品无致癌”!
证据27(1988年):农业部2014年7月28日《农业部信息公开申请答复书》【农公开(农)[2014]12号】确认:
农公开(农)[2014] 12号
杨晓陆、李香珍:
你们于2014年7月8日提交的关于孟山都草甘勝除草剂“农 达”毒理、残留及环境影响等政府信息公开申请收悉。现答复 如下。
2014年6月4日,我部农公开(农)[2014] 8号文已就草甘麟 除草剂“农达”毒理学试验报告信息公开事宜答复你们,不再重复 答复。现将毒理学试验结果和残留、环境质量影响有关信息函告 如下。 '
(一)毒理学试验结果:原药急性经口毒性为低毒;亚慢性及 慢性毒性试验结果表明,该产品毒性较低;代谢试验表明草甘滕在 体内无蓄积性,能较快地从体内排出;“三致”试验结果表明该产品无致癌、致突变和致畸性;每人每天允许摄入量0. lmg/kg bw0 “农达”制剂急性毒性为微毒,对家兔眼睛和皮肤无刺激性、无致 敏性。
(二) 农达“残留在作物及其产品中的残留、代谢、降解和分析 方法”:该产品残留检测方法采用气相色谱-火焰光度计检测器 法,柑橘中的检出限为0.3mg/kg,登记作物柑橘果肉中的残留量< 0. 3mg/kgo
(三) 农达“环境质量影响对大气、水、土壤、植物和生态系统 的污染和影响”:在土壤中易降解,对光稳定,对鱼、潢、鸟类和水生 生物低毒,在生物体内易排出,无积蓄现象。
(农业部信息公开申请答复专用章)
2014年7月28日

农业部2014年7月28日《信息公开申请答复书》【农公开(农)[2014]12号】扫描件
9、农业部《转基因权威关注》2011年9月转载《关于大豆中草甘膦残留限量标准情况》到现在持续9年坚持不懈竭力宣扬:“在试验条件下对动物未见致畸、致突变、致癌作用。”
证据28(2011年9月):农业部《转基因权威关注》转载东北农业大学陶波《关于大豆中草甘膦残留限量标准情况》宣扬:
(1)毒理学情况
按我国农药毒性分级,草甘膦原药为低毒。其大鼠急性经口LD50>5000(mg/kg),大鼠急性经皮LD50>2000 mg/kg,羊LD50>3530 mg/kg,兔急性经皮LD50>5000 mg/kg,大鼠急性吸入LD50(半致死浓度)>4.43 mg/L(4小时鼻暴露),对兔皮肤无刺激、眼睛有刺激。大鼠2年慢性喂养试验最大无作用剂量100 mg/kg(体重)/天。草甘膦对水生生物毒性较低,对蜜蜂和鸟类无毒害,对天敌及有益生物较安全。在试验剂量范围内,未见对试验动物有蓄积毒性、致突变、致畸、致癌作用。
......可见,草甘膦作为一种世界范围内广泛使用的除草剂,其毒性是非常低的,就鼠的经口毒性来说,比食盐的还要低。相关研究表明:草甘膦在动物体内不蓄积。在试验条件下对动物未见致畸、致突变、致癌作用。对鱼和水生生物毒性较低;对蜜蜂和鸟类无毒害;对天敌及有益生物较安全。
...
1、中国:现已制定了草甘膦11项残留限量标准(mg/kg),分别为稻谷0.1、小麦5、小麦粉0.5、全麦粉5、玉米1、水果0.1、甘蔗2、棉籽油0.05、茶叶1、柑橘0.5、苹果0.5。
... 由于我国没有推广抗草甘膦转基因大豆,同时草甘膦也不能在大豆田应用,因此目前尚未制定草甘膦在大豆中的限量标准。
五、草甘膦使用范围的扩大
... 保护性喷雾在玉米、高粱、大豆等作物株高25~30cm以上时,在喷雾器上安装保护罩进行喷雾,使药液雾滴不接触作物,而喷于杂草植株上。此外,这种喷雾方法也可用来防治稻田田埂杂草。甘蔗增糖:在甘蔗收割前10~15d ,喷洒低剂量草甘膦。
作物干燥与催熟:主要用于小麦、玉米、大豆与棉花等作物,通常在收获期前10~15d左右喷药,小麦、玉米用量0.25~0.85 kg/hm2,棉花用量0.85~4.0kg/hm2。在我国东北地区,由于生育期短,作物收获时籽粒含水量高,出现所谓“水苞米”现象,喷洒草甘膦将有助于解决这一问题。
陶波,关于大豆中草甘膦残留限量标准情况,农业部《转基因权威关注》,2011-09-19
http://www.moa.gov.cn/ztzl/zjyqwgz/zxjz/201109/t20110919_2290532.htm
10、拜尔公司收购孟山都公司后,草甘膦除草剂2018年向农业部申请续延“农药登记”时,依然谎称“微毒”!
证据29(2018年):《拜尔公司草甘膦异丙胺盐农药登记(PD73-88)》(有效期至:2023-04-15)标签注明:“微毒”!
农药登记证号:PD73-88
登记证持有人:拜尔股份公司
农药名称:草甘膦异丙胺盐
毒性及其标识:微毒
适用范围及施用方法:茶园、柑橘园、棉花免耕田、棉田行间、桑园、水稻田埂、橡胶园、玉米田(喷雾)。”
中华人民共和国农业农村部农药检定所《中国农药信息网》“农药登记”检索系统(截屏)
http://www.chinapesticide.org.cn/myquery/tagdetail?pdno=PD73-88
11、美国环保署(EPA)官方备忘录证实孟山都1983年与1988年提交了两项代谢研究揭示草甘膦在哺乳山羊与产蛋鸡中有“生物蓄积”致可食用组织草甘膦残留达到“肾脏(3.49-10.5 ppm),肝脏(0.457-0.529 ppm),脂肪和肌肉(0.009-0.011 ppm),奶(0.019-0.086)。
证据30(1989年1月):环保署健康影响分部饮食暴露处容限申请科化学家W. T. Chin博士致注册分部与健康影响粪便毒理学处负责人Robert J. Taylor备忘录《大豆中或上边的草甘膦(农达)》确认:
背景
孟山都农业产品公司已提议将40 CFR 180.364规定的除草剂草甘膦,N-(膦酰基甲基)甘氨酸及其代谢产物氨基甲基膦酸(AMPA)的混合残留物的容忍度从6 ppm和大豆的20 ppm提高至20 ppm,秸秆从15 ppm增加到200 ppm; 根据收割前的应用,大豆皮的40 CFR 561.253标准下的ppm由20 ppm降至100 ppm。...
申请方(孟山都公司)提交了以下两项新的陈代谢研究:
#405413-1:合成的13C /14C标签草甘膦和氨基甲基膦酸(AMPA)在哺乳山羊中的代谢研究(1988年2月)
简述:将13C / 14C(9:1)标记的草甘膦和AMPA的混合物(272.2 mg的草甘膦二钠盐和28.7 mg的AMPA一钠盐)以120 ppm的剂量口服给予三只哺乳山羊,该剂量依据以前的农作物残留研究,每天的日粮摄入量相当于预期暴露水平的3倍。对照山羊接受含蔗糖的胶囊。在最后一次给药后22和24小时处死两只服用处理的动物和对照动物,并收集血液、肌肉、肾脏、肝脏、脂肪和胃肠道内容物进行放射分析。在最后一次给药后,将一只接受服用处理的动物维持净化阶段5天,并持续收集牛奶,尿液和粪便。在第10天将经净化的动物宰杀,收集血液、肌肉、肾脏、肝脏、脂肪和胃肠道内容物,以通过燃烧和液体闪烁计数进行放射分析。
收集到的样品中放射性的总回收率在81.1%至86.7%之间,尿液和冲洗盘余物中的总回收率为20.2%至23.8%,粪便、瘤胃内容物和肠内容物合计回收率为60.2%至66.5%。牛奶中发现不到0.01%。消除的主要途径是尿液和粪便。在为期5天的净化期结束时,消除速率接近恒定速率。
组织中的大多数14C残留物都可以用水提取。这些残留物通过两种HPLC方法测定,并通过GC / MS确认为草甘膦和AMPA。没有证据表明任何组织中的草甘膦和AMPA有任何进一步的代谢。
在未净化动物的可食用组织中,14C残留量的确定如下:肾脏(3.49-10.5 ppm),肝脏(0.457-0.529 ppm),脂肪和肌肉(0.009-0.011 ppm),奶(0.019-0.086)。
2、第#405413-2号:产蛋鸡中使用合成13C / 14C标签草甘膦和氨基甲基膦酸(AMPA)的代谢研究(1988年2月)
简述:25只27周大的白来航鸡产蛋母鸡口服13C / 14C标记的草甘膦和AMPA的(9:1)混合物7天。五组鸡,每组5只的剂量分别为0 ppm(第1组),120 ppm(= 3X,第2、3和5组)和400 ppm(第4组)。每天收集粪便和蛋。在最后一次服用后22或24小时或10天处死鸡。收集肾脏、肝脏、大腿和胸部肌肉、卵巢、脂肪,鸡胗,剩余的消化道及其内容物和全血,分组中进行燃烧分析和液体闪烁计数放射分析。
收集的样品中放射性的总回收率为82.4%至90.5%,其中排泄物为81.0%至90.5%。胃肠道含量少于0.01%到2.11%,总产蛋量中少于0.02%,其他组织总和少于0.1%。服用后的最初24小时内,排泄物中约每日剂量的66.6%至78.4%被清除。
对于剂量为120 ppm的未净化组,其14C残留量确定如下:肾脏(1.75-1.81 ppm),肝脏(0.511-0.560 ppm),脂肪和肌肉(<0.026 ppm),鸡胗(0.352-0.361 ppm)。400 ppm组的所有组织和鸡蛋中残留水平比120 ppm组高三到四倍。鸡蛋中大多数14C残留物(小于或等于0.244 ppm)在蛋黄中。鸡蛋和组织中的14C残留物大多数是可水提取的。这些残留物通过两种HPLC方法测定,第4组肝脏中的14C残留物(400 ppm含量)通过GC / MS确认为草甘膦和AMPA,在纯化过程中可迅速消除。
EPA Memo Glyphosate(Roundup) in or on Soybeans, January 30, 1989
环保署备忘录:大豆中或上边的草甘膦(农达),1989年1月30日
https://archive.epa.gov/pesticides/chemicalsearch/chemical/foia/web/pdf/103601/103601-242.pdf


















