证据:毛主席故乡疾控中心、湘雅公共卫生学院团队呼吁“立即禁止使用”草甘膦除草剂“符合全球利益”!
15、毛主席故乡长沙市疾控中心、湖南省疾控中心、中南大学湘雅公共卫生学院团队2017年6月研究证实草甘膦除草剂农达损伤肝脏,公开呼吁“在数十年损害健康之后,在造成进一步危害之前,立即禁止使用这些致命化学物质符合全球利益”!
三、证据
1、《环境科学卫生杂志》2017年6月发表长沙市疾控中心、湖南省疾控中心、中南大学湘雅公共卫生学院团队研究:“最近,在致中国国家主席习近平的公开信中,欧洲数个非政府组织的成员要求中国禁止使用草甘膦(N-膦酰基甲基甘氨酸)”、“中国已经是世界上最大的草甘膦生产国、出口国和消费国。在数十年损害健康之后,在造成进一步危害之前,立即禁止使用这些致命化学物质符合全球利益”、“我们确定了草甘膦除草剂农达(Roundup)诱导的抗氧化系统抑制、线粒体损伤、DNA损伤、膜完整性和通透性变化以及L-02肝细胞的凋亡”。
证据01(2017年6月):《环境科学卫生杂志》(J Environ Sci Health B.)发表长沙市疾控中心、湖南省疾控中心、中南大学湘雅公共卫生学院卫生毒理学系罗雷、王非、Yiyuan Zhang、曾明、钟才高、肖芳获“国家自然科学基金会(81302456)”资助《农达除草剂(草甘膦)在L-02肝细胞中的体外细胞毒性评估》确认: 最近,在致中国国家主席习近平的公开信中,欧洲数个非政府组织的成员要求中国禁止使用草甘膦(N-膦酰基甲基甘氨酸)。草甘膦通过抑制莽草酸酯途径破坏植物和微生物,以前被认为对人类无毒[1]。1974年商业化的农达除草剂(Roundup),其有效成分是草甘膦。
草甘膦除草剂农达是目前使用最广泛的除草剂,可以在食物和饮用水中检出其残留物[2],引起人们对潜在的环境和人类健康影响的担忧。农达除草剂(Roundup)大鼠的口服急性致命中位剂量(LD50)为4,230 mg kg-1,曾被世界卫生组织(WHO)分类为“正常使用中不太可能出现急性危害”[3]。
在国际癌症研究机构(IARC)最近的一份报告指出农达除草剂(Roundup)对人类可能是致癌之前,农达除草剂(Roundup)一直被认为是“安全的”[4]。一些使用农达除草剂(Roundup)的农业工人遇到了怀孕问题,并且已证实浓度低于农业使用中所发现浓度的农达除草剂(Roundup)对人胎盘JEG3细胞有毒性[5]。最近的研究表明,人尿中发现的低含量的草甘膦可以促进人乳腺癌细胞的生长,证实了这种除草剂的致癌潜力[6]。因此,禁止草甘膦除草剂农达(Roundup)的禁令有多近?...
中国已经是世界上最大的草甘膦生产国、出口国和消费国。在数十年损害健康之后,在造成进一步危害之前,立即禁止使用这些致命化学物质符合全球利益。
本研究的目的是阐明草甘膦农达除草剂(Roundup)对L-02肝细胞的体外细胞毒性作用。
通过检测活性氧(ROS)的产生,谷胱甘肽(GSH)/超氧化物歧化酶(SOD)的水平,线粒体通透性转换孔(PTP)的开放率,凋亡诱导因子(AIF)释放,细胞内Ca2 +浓度和丙氨酸氨基转移酶(ALT) )/天冬氨酸转氨酶(AST)泄漏,我们确定了草甘膦除草剂农达(Roundup)诱导的抗氧化系统抑制、线粒体损伤、DNA损伤、膜完整性和通透性变化以及L-02肝细胞的凋亡。
通过揭示草甘膦除草剂农达(Roundup)诱导的细胞毒性的机理见解,我们的结果对于为接触草甘膦除草剂农达(Roundup)和其他杀虫剂的职业人群设计预防和治疗策略非常有价值。
Luo L, Xiao F. et al.,In vitro cytotoxicity assessment of roundup (glyphosate) in L-02 hepatocytes. J Environ Sci Health B. June 2017;52:410–7.
罗雷、王非、Yiyuan Zhang、曾明、钟才高、肖芳,农达除草剂(草甘膦)在L-02肝细胞中的体外细胞毒性评估。环境科学卫生杂志。2017年6月;52:410–7.
https://pubmed.ncbi.nlm.nih.gov/28281894/
2、尼日利亚Ibadan大学生物化学系学者1990年4月研究:“这些结果表明,尽管PMG(草甘膦)增加了线粒体膜对质子和Ca2 +的渗透性,但除草剂似乎不像真正的质子体那样起作用。因此,其解偶联作用可能是由于其既可以充当螯合剂又可以充当温和的质子体”。
证据02(1990年4月):《毒理学》(Toxicology)发表尼日利亚Ibadan大学生物化学系Olorunsogo, O.O.《N-(膦酰基甲基)甘氨酸修饰质子和Ca2C离子跨线粒体耦合膜的转运》确认: N-(膦酰基甲基)甘氨酸(即“草甘膦”)(PMG),一种广谱和非选择性除草剂以浓度依赖的方式增强了悬浮在0.15 N NH4Cl中的线粒体膜的质子渗透性。在大于或等于600 microM PMG(草甘膦)的浓度下,观察到这些膜的光散射显着降低。因此,PMG(草甘膦)的作用比经典的氧化磷酸化解偶联剂FCCP的作用低几倍。使用敏感的pH玻璃电极,PMG(草甘膦)显着增强了质子向线粒体基质的移动。
此外,PMG(草甘膦)诱导的Ca2+离子通过通电的线粒体累积后释放的速率仅略微超过FCCP诱导的Ca2+离子释放速率的一半(1 microM)。尽管Ca2+或Mg2+仅略微降低了PMG(草甘膦)诱导的作用,但将甘氨酸包含在反应介质中对PMG(草甘膦)诱导的作用没有任何影响。这些结果表明,尽管PMG(草甘膦)增加了线粒体膜对质子和Ca2 +的渗透性,但除草剂似乎不像真正的质子体那样起作用。因此,其解偶联作用可能是由于其既可以充当螯合剂又可以充当温和的质子体。
Olorunsogo, O.O. Modification of the transport of protons and Ca2C ions across mitochondrial coupling membrane by N -(phosphonomethyl)glycine. Toxicology. April 1990, 61, 205–209.
Olorunsogo, O.O.,N-(膦酰基甲基)甘氨酸修饰质子和Ca2C离子跨线粒体耦合膜的转运。毒理学。1990年4月;61, 205–209.
https://pubmed.ncbi.nlm.nih.gov/2157305/
3、巴西Santa Catarina州联邦大学神经生物学和细胞与分子血液学实验室、临床分析系、血液学中心血液病理实验室2004年11月研究:“长期服用低剂量Biocarb®品牌草甘膦除草剂的大鼠会增加肝-天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)向动物血清的释放。这伴随着肝肝组织的变化,网状蛋白纤维的沉积较大,随后库普弗细胞(Kupffer cells)增加,提示结缔组织增加”。
证据03(2004年11月):《毒理学通讯》(Toxicology Letters)发表巴西Santa Catarina州联邦大学校神经生物学和细胞与分子血液学实验室、临床分析系、血液学中心血液病理实验室A L Benedetti et al.《Wistar大鼠亚慢性暴露于Biocarb®品牌除草剂草甘膦的影响》确认: 已有报道,长期暴露于草甘膦会在妊娠大鼠中引起毒性以及胎儿骨化不足(Dallegrave等,2003)。在亚慢性暴露于草甘膦除草剂农达(Rundup®)时观察到了这种致畸作用。在其他研究中,对大鼠进行了使用草甘膦原药(technical glyphosate)的长期给药。在1979-1981年和1988-1990年进行这方面的研究(WHO, 2003)。在第一项1979-1981年期间研究中,动物每天接受3、10和32 mg / kg的剂量,在第二项1988-1990年期间研究中,动物每天接受100、410和1060 mg / kg的剂量。在第一项研究中,观察到大鼠间质细胞瘤的发生率显着增加,但是,在第二项研究中,使用更高剂量的药物缺乏相同的效果是将草甘膦排除在致癌类别之外的基础(WHO, 2003)。
我们在这里报告,长期服用低剂量Biocarb®品牌草甘膦除草剂的大鼠会增加肝-天冬氨酸转氨酶(AST)和丙氨酸转氨酶(ALT)向动物血清的释放。这伴随着肝肝组织的变化,网状蛋白纤维的沉积较大,随后库普弗细胞(Kupffer cells)增加,提示结缔组织增加。
在75天内,对实验动物每2天口服给水或含4.87、48.7或487 mg / kg草甘膦的水。从最低剂量的草甘膦开始对动物进行亚慢性处理会引起肝细胞内酶、丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)的泄漏,提示肝细胞不可逆转的损伤。
我们观察到草甘膦处理过的动物的肝窦中库普弗细胞(Kupffer cells)的增加。 随后是网状蛋白纤维的大量沉积,主要由III型胶原组成。我们可能得出的结论是,Biocarb®品牌草甘膦除草剂可能在实验模型中诱导肝组织学变化以及AST和ALT从肝脏泄漏到血清。
这些数据表明该产品具有一定程度的肝毒性,并提出了对其操作相关副作用进行更深入研究的必要性。
A L Benedettiet al., The effects of sub-chronic exposure of Wistar rats to the herbicide Glyphosate-Biocarb®. Toxicology Letters. Nov 2004; 153(2) pp227-232
A L Benedettiet al.,Wistar大鼠亚慢性暴露于Biocarb®品牌除草剂草甘膦的影响。
毒理学通讯。2004年11月;153(2) pp227-232
https://www.sciencedirect.com/science/article/abs/pii/S0378427404002188
4、科学家塞拉里尼团队2005年6月研究:“低于农业使用时浓度的草甘膦在18小时内对人胎盘JEG3细胞具有毒性,... 草甘膦除草剂农达(Roundup)始终比其活性成分(草甘膦)具有更高的毒性”、“草甘膦除草剂会破坏芳香化酶活性和mRNA水平,并与纯化的酶的活性位点相互作用,但是草甘膦除草剂配方在微粒体或细胞培养物中的作用促进草甘膦的毒性作用”、“在哺乳动物中不仅可以观察到草甘膦的内分泌和毒性作用,而且还可以观察到农达除草剂的内分泌和毒性作用。...农达除草剂佐剂的存在会增强草甘膦的生物利用度和/或生物蓄积性”。
证据04(2005年6月):《环境卫生观点》(Environ. Health.Perspect.)发表法国卡昂大学生物研究所生物化学实验室Richard, S与科学家塞拉里尼合作研究《草甘膦和农达除草剂对人类胎盘细胞和芳香化酶的差异作用》确认: 农达(Roundup)是草甘膦基除草剂,在全世界范围内使用,包括设计用于耐受它的大多数转基因植物。因此,其残留物可能进入食物链,草甘膦被发现为河流中的污染物。一些使用草甘膦的农业工人有妊娠问题,但其在哺乳动物中的作用机理受到质疑。
在这里,我们显示低于农业使用时浓度的草甘膦在18小时内对人胎盘JEG3细胞具有毒性,并且这种作用随浓度和时间或在农达佐剂的存在下增加。令人惊讶的是,草甘膦除草剂农达(Roundup)始终比其活性成分(草甘膦)具有更高的毒性。
我们测试了较低的无毒浓度下的草甘膦和农达除草剂对芳香酶的作用,芳香酶是负责雌激素合成的酶。草甘膦除草剂会破坏芳香化酶活性和mRNA水平,并与纯化的酶的活性位点相互作用,但是草甘膦除草剂配方在微粒体或细胞培养物中的作用促进草甘膦的毒性作用。
我们得出的结论是,在哺乳动物中不仅可以观察到草甘膦的内分泌和毒性作用,而且还可以观察到农达除草剂的内分泌和毒性作用。我们提议,农达除草剂佐剂的存在会增强草甘膦的生物利用度和/或生物蓄积性。
Richard, S.; Seralini, G.E. Differential effects of glyphosate androundup on human placental cells and aromatase. Environ. Health.Perspect. June 2005, 113, 716–720.
Richard, S.; Seralini, G.E。草甘膦和农达除草剂对人类胎盘细胞和芳香化酶的差异作用。
环境卫生观点。2005年6月,113, 716–720.
https://pubmed.ncbi.nlm.nih.gov/15929894/
5、中南大学王非2008年11月硕士论文结论:“农达在60mg/L~180mg/L范围内,能引起L-02肝细胞存活率下降,细胞膜通透性增加,抑制细胞离子转运,诱发DNA损伤,线粒体膜电位降低,Cyt C、AIF等凋亡因子泄漏,使细胞产生凋亡和坏死,对肝细胞具有明显的损伤作用;其损伤的作用机制可能与农达导致肝细胞氧化损伤、线粒体崩溃等途径有关。”
证据05(2008年11月):中南大学王非硕士论文《农达(41%草甘膦)对人L-02肝细胞损伤的研究》(指导教师:钟才高)确认: 体外试验和体内试验都已证明,肝脏(肝细胞)是草甘膦主要的靶器官之一。 肝脏作为体内最大的脏器,具有特殊的生理生化功能和独特解剖结构和特征。肝脏易成为外源性化合物产生的毒作用靶器官。外源性化学物质经过各种途径进入机体后,均可通过血液循环达到肝脏,特别是经消化道吸收的外源性化学物。外源性化学物在肝脏内进行生物转化,在一定条件下,易对肝细胞产生损害作用[10]。
国内外对于农达和草甘膦对机体产生的影响的研究,主要集中在其产生的肝、肾损害。有学者研究表明,经草甘膦亚慢性处理的成年Wistar大鼠出现肝细胞内酶ALT、AST的泄漏,说明肝细胞出现不可逆的损伤,草甘膦处理组肝枯佛细胞增多[11]。草甘膦孕期暴露,导致母鼠增重比对照组少。肝重小于对照组:母子肝脂质过氧化物均高于对照组。草甘膦暴露和肝代谢导致MDA过表达和氧化应激,造成ROS过量,过量的ROS通过脂质、蛋白质、DNA的氧化损伤影响细胞完整性,改变基因功能调节影响发育、分化和衰老[12]。研究草甘膦对大鼠微粒体细胞色素p450基因表达的影响,结果显示草甘膦二组CYP281 mRNA水平增加62%,草甘膦一组CYP281 mRNA水平增加36%,肾脏CYP281 mRNA水平显著降低。Peixoto F等研究农达和草甘膦对线粒体氧化磷酸化影响,结果表明农达刺激琥珀酸盐支持的呼吸作用,同时跨膜电位消失,15mM农达抑制3期呼吸作用达40%,线粒体在等渗的蔗糖基质中肿胀度表明非特异的线粒体膜通透性增加[14]。研究大鼠肝线粒体的生物能量机能研究农达和他的主要成分草甘膦的潜在毒性,抑制呼吸作用3期[14],草甘膦降低肝CYTP450水平,和单氧合酶(monooxygenase)活性[16]。电镜观察鲤鱼暴露于农达的结果表明,除草剂引起了其肝细胞髓样变,线粒体肿胀,和线粒体内膜消失[17]。这些研究结果表明草甘膦暴露对肝脏功能和结构均产生影响。
以农达为代表的草甘膦类农药产品用量大,范围广,急性毒性低。正是这个原因,人们更容易忽略其长期毒效应。现有的国内外研究主要集中在草甘膦类农药可能对多种生物机体体内实验中产生的肝脏毒性、生殖毒性、遗传毒性等等,少有研究其体外实验中肝脏及其他系统的代谢、功能和细胞增生影响的机制和途径,以及各个系统对农达和草甘膦的敏感性。肝脏是农达等草甘膦农药的主要靶器官之一,是为更好的了解农达对肝细胞产生的损害及其机制,本实验选取农达为受试物,L-02人类肝细胞为受试对象,系统的研究农达在体外试验中对肝细胞产生的损伤及其机制,期望能确定肝损伤产生的途径和机制,从而更好的为人
类健康服务。
方法: 体外试验(in vitro test)以L-02肝细胞为受试细胞,通过MTT法检测不同浓度的农达对L-02肝细胞存活率的影响,选择细胞存活率为20%-80%的浓度进行后续实验。设置5个农达处理组,60mg/L、90mg/L、120mg/L、150mg/L、180mg/L和1个阴性对照组(PBS),农达处理细胞时间为24h。L-02肝细胞的形态学改变采用姬母萨染色法在光镜下观察结合透射电镜观察;农达对L-02肝细胞膜通透性影响和细胞毒性作用采用谷草转氨酶(AST)、谷丙转氨酶(ALT)活性水平结合台盼蓝拒染法来评价;农达诱导L-02肝细胞氧化损伤程度选用超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)含量等指标评价;用线粒体跨膜电位(△Ψm)检测细胞线粒体损伤;用DNA条带(DNA-Ladder)检测肝细胞DNA损伤;以AnnexinV-FITC/PI复染法测定细胞发生凋亡和坏死的情况;Western Blotting检测对照组与90mg/L组细胞色素C(Cyt C)和凋亡诱导因子(AIF)表达水平。
结果: 在60~180mg/L的处理浓度范围内,能明显引起L-02肝细胞存活率的降低(P<0.05),处理浓度和细胞存活率之间存在负相关(r=-0.974)。 在光镜下观察姬母萨染色L-02肝细胞爬片,观察到各农达处理组L-02肝细胞皱缩或肿大,形态由瓦片状收缩为圆形,细胞间隙扩大,细胞破裂,染色质浓缩,贴壁细胞密度和数量减少。电镜下观察,可发现处理组细胞出现表面微绒毛消失,细胞膜结构不完整,细胞核碎裂或肿胀,线粒体空泡样变等细胞凋亡或坏死的表现。 农达处理L-02肝细胞,其活细胞台盼兰蓝染比例升高(P<0.05);细胞培养上清液中ALT活性增加(P<0.05);从90mg/L组开始AST活性增加(P<0.05);农达导致处理组细胞内MDA的含量增加,SOD活性减弱,GSH含量减少(P<0.05);农达导致120~180mg/L组细胞Na~+-K~+ ATP酶活性降低(P<0.05)。 农达处理能诱导细胞DNA链断裂,处理浓度在150mg/L、180mg/L,DNA受损程度严重;90mg/L组Cyt C和AIF表达水平高于对照组(P<0.05);90mg/L组开始用农达处理的L-02细胞线粒体膜电位明显降低(P<0.05);农达能明显诱导处理组肝L-02细胞发生凋亡和坏死(P<0.05),随着处理农度的增高,细胞凋亡和坏死的比例增高,但是在180mg/L组凋亡比例下降。 结论: 农达在60mg/L~180mg/L范围内,能引起L-02肝细胞存活率下降,细胞膜通透性增加,抑制细胞离子转运,诱发DNA损伤,线粒体膜电位降低,Cyt C、AIF等凋亡因子泄漏,使细胞产生凋亡和坏死,对肝细胞具有明显的损伤作用;其损伤的作用机制可能与农达导致肝细胞氧化损伤、线粒体崩溃等途径有关。
王非,农达(41%草甘膦)对人L-02肝细胞损伤的研究,
中南大学(硕士论文),2008年11月
http://www.cdmd.cnki.com.cn/Article/CDMD-10533-2008165795.htm
6、法国科学家塞拉里尼领衔团队2009年8月研究:“草甘膦除草剂对人类细胞和体内DNA造成损害和“致癌、致突变、致生殖毒性”(CMR)效应”、“必须考虑食品,饲料或环境中草甘膦除草剂残留物对细胞的实际影响,讨论其分类为致癌物/诱变剂/生殖毒性物质”
证据06(2009年8月):《毒理学》(Toxicology)发表法国卡昂大学生物研究所生物化学实验室、法国Burgundy大学食物毒理学实验室法国科学家塞拉里尼领衔团队研究《草甘膦除草剂是人细胞系中有毒和内分泌干扰物》确认: 草甘膦基除草剂是世界上使用最广泛的除草剂。它们以不同的配方商业化。它们的残留物是环境中的常见污染物。另外,这些除草剂喷洒在经过修饰其细胞中可耐受高含量草甘膦的大多数食用转基因作物上。某些饲料中最多接受400 ppm的残留物。
我们将人类肝脏HepG2细胞(一种研究异种生物毒性的著名模型)暴露于四种不同的制剂和草甘膦(通常在慢性体内调节研究中单独进行测试)。我们使用基因报告基因测试通过三种测定(Alamar Blue,MTT,ToxiLight)、遗传毒性(彗星测定)、抗雌激素(对ERalpha,ERbeta)和抗雄激素作用(对AR)来测量细胞毒性。我们还通过芳香化酶活性和mRNA检查了雄激素向雌激素的转化。
在24小时内,所有制剂均以低于农业施用剂量破坏了所有参数。这些影响更多地取决于制剂而不是草甘膦浓度。首先,对于活性最高的制剂(R400),我们在MDA-MB453-kb2细胞中雄激素受体上的0.5 ppm处观察到了人类细胞内分泌的破坏;然后在2 ppm上,HepG2也抑制了两种雌激素受体上的转录活性。芳香酶的转录和活性从10 ppm浓度水平开始中断。细胞毒性作用始于Alamar Blue分析(最灵敏),浓度为10 ppm,DNA损伤浓度为5 ppm。
总之,根据这些数据和文献,草甘膦除草剂对人类细胞和体内DNA造成损害和“致癌、致突变、致生殖毒性”(CMR)效应。草甘膦(G)的直接作用最可能由佐剂或类似洗涤剂(表面活性剂)的物质形成的囊泡所放大,这些物质允许其细胞渗透、稳定并可能改变其生物利用度,从而改变新陈代谢(Benachour and Séralini, 2009)。这些洗涤剂(表面活性剂)也可能以污染物的形式存在于河流中。然后应在草甘膦除草剂作用的流行病学研究中准确确定制剂的类型(Acquavella et al., 2006)。
当然,为了推进关于体内作用的假设,不仅应考虑体内稀释、消除、代谢,还应考虑生物蓄积和时间放大作用(Benachour et al., 2007b)。这些除草剂混合物还以远低于农业稀释度的剂量以及对线粒体活性和膜完整性的毒性水平对人体细胞表现出内分泌干扰物(ED)作用。这些剂量与转基因饲料中允许的残留水平上一致,本文是它们在人类细胞中这些现象的第一个清晰证明。
因此,必须考虑食品,饲料或环境中草甘膦基除草剂残留物对细胞的实际影响,并讨论其分类为致癌物/诱变剂/生殖毒性物质。
Gasnier,C, Dumont,CN,SéraliniG-E et al., Glyphosate-based herbicides are toxic and endocrine disruptors in human cell lines. Toxicology. 2009, 262, 184–191.
Gasnier,C, Dumont,CN,SéraliniG-E et al.,草甘膦除草剂是人细胞系中
有毒和内分泌干扰物。毒理学。2009, 262, 184–191.
https://pubmed.ncbi.nlm.nih.gov/19539684/
7、韩国天安市淳春市大学医学院免疫学科、内科团队2012年7月研究:草甘膦除草剂混合物存在中的草甘膦与不同种类表面活性剂。该项研究“调查了草甘膦是否会影响表面活性剂TN-20和LN-10对小鼠成纤维样细胞、肺泡上皮细胞和心脏细胞系的细胞毒性”,发现“它们单独具有可比的毒性,随细胞系的不同而变化,并且可以是累加性、拮抗性或导致增强”。该项研究引用“在先前的病例报告中,通过HPLC / PCR对组织样本进行死后分析时,据报道表面活性剂的浓度在大脑中为100 ppm,在血液中为550 ppm,在肝脏中为60 ppm,在肾脏中为3,650 ppm”。
证据07(2012年7月):《韩国医学科学杂志》(J.Korean. Med. Sci.)发表韩国天安市淳春市大学医学院免疫学科、内科Song, H.Y.et al.《含表面活性剂草甘膦混合物的体外细胞毒性作用》确认: 在过去的20年中,已经进行了大量研究来研究草甘膦表面活性剂毒性的性质,包括临床毒理学[3-5],并且已经提出了针对这种现象的几种可能的机制。 例如,除了这些试剂的个体毒性外,表面活性剂和草甘膦的混合物不仅可能引起直接毒性,而且可能对这些化合物中任一个或两者的毒性产生协同作用。
术语”混合物毒性”是指化学物质混合时可能发生的不良副作用。
尽管在过去的几十年中对混合物毒理学的研究已取得重大进展[10, 11],但大多数检查除草剂混合物毒性的研究都使用除草剂和杀虫剂或杀真菌剂进行[12]。
因此,我们最近评估了除草剂配方中通常包含的表面活性剂的细胞毒性[13]。 其中,聚氧乙烯牛脂胺(TN-20)和聚氧乙烯月桂胺醚(LN-10)在韩国的草甘膦除草剂中很常见。
我们调查了草甘膦是否会影响表面活性剂TN-20和LN-10对小鼠成纤维样细胞、肺泡上皮细胞和心脏细胞系的细胞毒性。通过评估膜的完整性,确定存在或不存在草甘膦的情况下,TN-20和LN-10(0.4-100 µM)的细胞毒性。
与单独的TN-20相比,在存在50 µM草甘膦的情况下,TN-20对于成纤维细胞样细胞毒性显着降低(6.25 µM; 3.9%±3.4%对-4.8%±0.7%),对于肺泡细胞也显着降低(0.78 µM; 5.7%±0.9% 对0.1%±0.6%),并且对于心脏细胞系也显着降低(25.0 µM;7.9%±3.0%vs 19.4%±0.7%)。
与单独的LN-10相比,在存在50 µM草甘膦的情况下,发现当LN-10浓度为50 µM时,LN-10对成纤维细胞样细胞的细胞毒性增加(31.3%±3.9%对19.2%±0.9%),当LN-10浓度为100 µM时,LN-10对成纤维细胞样细胞的细胞毒性增加(62.1%±3.4%对39.0%±0.7%)。
这些结果表明,在急性草甘膦除草剂中毒患者中,混合物的毒性可能是含表面活性剂草甘膦除草剂毒性的一个因素。
讨论
本研究的主要发现是草甘膦对TN-20和LN-10表面活性剂细胞毒性的影响,它们单独具有可比的毒性,随细胞系的不同而变化,并且可以是累加性、拮抗性或导致增强。
可加性(Additivity)是指两种物质的总作用等于它们各自作用之和的情况,而如果两种物质互相抵消,并且/或者如果一种物质本身无毒,则会产生拮抗作用(antagonism), 抑制其他物质的作用。 增强作用(Potentiation)是一种现象,一种自身不发挥毒性作用的物质,会增强另一种有毒物质的毒性[15]。
在我们的研究中,发现草甘膦与两种表面活性剂的混合毒性在成纤维细胞样细胞中具有拮抗作用。 发现TN-20和草甘膦的混合物在肺泡细胞中具有拮抗作用,而LN-10和草甘膦的混合物被发现具有累加作用。 最后,在心脏细胞系中,草甘膦与TN-20和LN-10的混合物均能增强作用。
由于这项研究并非旨在评估联合作用的定性方面,因此我们无法解释增强作用和/或拮抗作用的机制。 但是,有强有力的证据表明,具有共同特定作用方式的化学物质协同作用,可产生比每种单一混合物组分更大的组合作用。
考虑到这是一项体外实验,我们相信我们的发现还表明表面活性剂和草甘膦的混合毒性可能是体内细胞和/或器官特异性的。 因此,应在体内进行进一步的毒代动力学研究。
混合物毒性的定量方面通常以毒性单位(TA)表示。 然后,剂量(DA)与该物质的有效剂量(EDA)相关,因此:TA = DA / EDA有毒单位[16]。 对于2种物质的混合物,结果可以表示为混合物中物质A的数量与物质B的数量。因此,比较结果的最简单方法是将两种数量均表示为有效剂量(浓缩)和毒性单位:TA = DA / EDA,TB = DB / EDB。
在我们的实验环境中,两种表面活性剂在1μM和100μM之间的浓度下均显示出细胞毒性,而在该范围内未发现草甘膦具有细胞毒性。 为了避免任何混合物毒性,因此将相对较高但相当浓度的草甘膦(50或100μM)添加到表面活性剂中。
选择这两个草甘膦浓度是因为,首先,我们认为,如果草甘膦和表面活性剂之间发生混合毒性,则反应将基于摩尔比进行,因此化学物质的浓度可相互比较。 其次,我们希望体外实验中使用的化学物质浓度与体内潜在的化学物质浓度相当。
通常,草甘膦除草剂产品按体积计由25%-40%的草甘膦和10%-20%的表面活性剂组成。 由于缺乏体内使用TN-20和LN-10的毒物代谢动力学研究,我们无法确定这些表面活性剂的体外等效浓度与引起草甘膦表面活性剂毒性的血液浓度。
然而,在先前的病例报告中,通过HPLC / PCR对组织样本进行死后分析时,据报道表面活性剂的浓度在大脑中为100 ppm,在血液中为550 ppm,在肝脏中为60 ppm,在肾脏中为3,650 ppm[10]。
基于每个体外细胞系与体内细胞具有生物学相似性的假设,我们为实验选择了三种不同的细胞系(成纤维样细胞、肺泡细胞和心脏细胞)。
尽管我们理想情况下也会在本研究中包括神经细胞系,但由于中枢神经系统恶化是草甘膦表面活性剂毒性的常见并发症,但在初步研究中发现神经细胞系生长太慢而无法包被。
但是,我们关于心脏细胞系混合物毒性的研究结果可能与急性草甘膦除草剂中毒患者经常观察到的心血管不稳定性有关[6],包括低血压和心律不齐。
我们的研究在将体外实验的结果扩展到临床实践方面存在局限性。 首先,体外实验中使用的草甘膦和表面活性剂的浓度可能不是急性草甘膦中毒患者血清水平的浓度。 此外,在我们的实验中使用的相对浓度(草甘膦-表面活性剂比率)可能不是体内的相对浓度。
即使有这些限制,我们的发现也为草甘膦与TN-20和LN-10表面活性剂之间的混合物毒性提供了体外证据。 这也证明了这些作用可能是累加的,拮抗的或导致增强作用,这取决于所检查的细胞系。 因此,我们认为在草甘膦除草剂中毒急性患者中,混合物的毒性可能与草甘膦表面活性剂的毒性有关。
Song, H.Y.et al.,Invitro cytotoxic effect of glyphosate mixture containing surfactants.
J.Korean. Med. Sci. July 2012, 27, 711–715.
Song, H.Y.et al.,含表面活性剂草甘膦混合物的体外细胞毒性作用。
韩国医学科学杂志。2012年7月;27, 711–715.
https://pubmed.ncbi.nlm.nih.gov/22787363/
8、阿根廷布宜诺斯艾利斯省国立大学中心兽医学院生物与生态毒理学实验室、兽医学院药理学实验室学者2012年9月研究《暴露于含亚致死量除草剂草甘膦饮用水对大鼠的影响》声称“对这种除草剂的低水平暴露不会产生组织形态学变化”,然而论文承认他们试验中使用的不是草甘膦除草剂农达制剂,而是单一成分草甘膦化学品。
证据08(2012年9月):《环境毒理学药理学》(Environ.Toxicol. Pharmacol.)发表阿根廷布宜诺斯艾利斯省国立大学中心兽医学院生物与生态毒理学实验室、兽医学院药理学实验室Larsen, Ket al.《暴露于含亚致死量除草剂草甘膦饮用水对大鼠的影响:谷氨酸硫酮转移酶活性,肝、肾和小肠中谷胱甘肽还原水平和脂质过氧化的水平》确认: 草甘膦(GLP)是许多除草制剂的活性成分,是一种广谱除草剂化合物。Wistar大鼠在30或90天内暴露于(美国环保署)允许人类饮用最高含草甘膦(0.7 mg / L)(US EPA, 2011)和高10倍浓度(7 mg / L)的饮水。
对这种除草剂的低水平暴露不会产生组织形态学变化。与未暴露于除草剂的对照动物相比,硫代巴比妥酸反应性物质(TBARS)的产量相似或趋于降低。 在暴露于草甘膦(GLP)的大鼠中,减少的谷胱甘肽(GSH)和增加的谷胱甘肽过氧化物酶(GPx)活性的水平升高可能是针对除草剂可能有害作用的保护机制。
总的来说,这项工作显示出某些生化修饰,即使草甘膦(GLP)剂量比口服参考剂量2mg / kg /天(US EPA, 1993)低3-20倍。这些发现的毒理学意义尚待阐明。
化学物:本试验中使用的草甘膦(Glyphosate)等化学物购买自美国Sigma-Aldrich公司(美国密苏里州圣路易斯市)。
Larsen, Ket al.,Effects of sub-lethalexposure of rats to the herbicide glyphosate in drinking water: Glutathione transferase enzyme activities, levels of reduced glutathioneand lipid peroxidation in liver, kidneys and small intestine.
Environ.Toxicol. Pharmacol. 2012, 34, 811–818.
Larsen, Ket al.,暴露于含亚致死量除草剂草甘膦饮用水对大鼠的影响:谷氨酸硫酮转移酶活性,肝、肾和小肠中谷胱甘肽还原水平和脂质过氧化的水平。
环境毒理学药理学。2012年9月;34, 811–818.
https://pubmed.ncbi.nlm.nih.gov/23044091/
9、泰国Chulabhorn研究生院环境性毒理学计划、应用生物学科学计划、药理学实验室;教育部高等教育委员会环境性健康与毒理学卓越中心团队2013年9月研究:“草甘膦在万亿分之一到百万分之一浓度通过雌激素受体蛋白促进T47D癌细胞系生长”、“在低的与环境性相关浓度下,草甘膦具有雌激素性活动... 存在着草甘膦与大豆中的一种植物雌激素染料木黄酮之间的额外雌激素作用”。
证据09(2013年9月):《食物与化学毒理学》(Food and Chemical Toxicology)泰国Chulabhorn研究生院环境性毒理学计划、应用生物学科学计划、药理学实验室;教育部高等教育委员会环境性健康与毒理学卓越中心Siriporn Thongprakaisang et al.《草甘膦通过雌激素受体蛋白诱发人类乳房癌细胞生长》确认: 要点:
-- 草甘膦在万亿分之一到百万分之一浓度通过雌激素受体蛋白促进T47D癌细胞系生长
-- 草甘膦产生可由ICI 182780断阻的ERE(雌激素反应元素)活动性。
-- 草甘膦通过增加ER(雌激素受体蛋白)的表达率与ER改变雌激素受体蛋白。
-- 草甘膦与染料木黄酮一起对ERE(雌激素反应元素)活动性与细胞生长产生额外作用。
摘要:
草甘膦是最为广泛使用并被人们相信比其他农药毒性较低的除草剂的活性成分。然而,最近几项研究显示它对人类潜在危害健康,而且可能是一种内分泌干扰剂。
该项研究集中于纯草甘膦对雌激素受体蛋白促进的转录活动性及其表达。草甘膦,在10-12至10-6M(万亿分之一至百万分之一质量)范围,在雌激素撤走状态下仅对人类激素-依赖乳房癌细胞T47D细胞发挥增殖作用,而对激素-独立乳房癌细胞MDA-MB231细胞系没有这种作用。
诱发ERE(雌激素反应元素)转录活动性达到T47D-KBluc细胞中对照组的5-13倍的产生增殖作用剂量的草甘膦,受到一种雌激素对抗药ICI 182780的抑制,表明草甘膦的雌激素活动性通过雌激素受体蛋白发挥作用。此外,草甘膦既改变雌激素受体蛋白α,又改变其β表达。
这些结果显示,在低的与环境性相关浓度下,草甘膦具有雌激素性活动。草甘膦为基础的除草剂广泛用于(转基因)大豆种植,而我们的结果发现,存在着草甘膦与大豆中的一种植物雌激素染料木黄酮之间的额外雌激素作用。然而,草甘膦对于(转基因)大豆的这种额外的作用需要进行进一步的动物试验。
Siriporn Thongprakaisang et al., Glyphosate induces human breast cancer cells growth via estrogen receptors, Food and Chemical Toxicology, 2013 Sep;59:129-36.
Siriporn Thongprakaisang et al.,草甘膦通过雌激素受体蛋白诱发人类乳房癌细胞生长,
食物与化学毒理学,2013年9月;59:129-36.
https://www.sciencedirect.com/science/article/abs/pii/S0278691513003633?via%3Dihub
10、巴西Santa Catarina州联邦大学生物化学系和生物科学中心、生物科学中心生态与动物学系等机构学者团队2013年12月研究:“低剂量的农达除草剂急性暴露30分钟可诱导氧化应激并激活多种应激反应途径,导致青春期前睾丸睾丸支持细胞死亡”、“草甘膦已被描述为一种影响男性生殖系统的内分泌干扰物”、“我们提议,草甘膦除草剂农达毒性,涉及Ca(2+)超载、细胞信号失调、内质网的应激反应和/或耗尽的抗氧化剂防御,可能会导致精子发生中的支持细胞分裂,可能对男性生育力产生影响”。
证据10(2013年12月):《自由基生物学和医学》(Free.Radic. Biol. Med.)发表巴西Santa Catarina州联邦大学生物化学系和生物科学中心、生物科学中心生态与动物学系;Rio Grande do Sul州联邦大学基本健康科学研究所生物化学系Cavalli, V.L.D.L.O.et al.《草甘膦除草剂农达通过触发大鼠睾丸和睾丸支持细胞中钙介导的细胞死亡破坏雄性生殖功能》确认: 草甘膦是商业性农达除草剂(Roundup)的主要活性成分。目前的结果表明,低剂量(36 ppm,0.036 g / L)的农达除草剂(Roundup)急性暴露30分钟可诱导氧化应激并激活多种应激反应途径,导致青春期前睾丸睾丸支持细胞死亡。
通过打开L型电压依赖性Ca(2+)通道以及内质网IP3和兰尼碱受体(ryanodine receptors),该除草剂增加了细胞内Ca(2+)的浓度,导致细胞内Ca(2+)超载,从而引发了氧化反应和坏死细胞死亡。
同样,单独成分草甘膦(36 ppm)孵育30分钟的睾丸也可增加(45)Ca(2+)的吸收。这些事件被抗氧化剂三氧化二氮(Trolox)和抗坏血酸所阻止。激活的蛋白激酶C,磷脂酰肌醇3激酶和有丝分裂原激活的蛋白激酶,如ERK1 / 2和p38MAPK,在引起Ca(2+)大量涌入和细胞死亡中起作用。
农达除草剂降低了还原型谷胱甘肽(GSH)的水平,并增加了硫代巴比妥酸反应性物种(TBARS)和蛋白质羰基的含量。
同样,暴露于草甘膦-农达除草剂(Roundup)刺激了谷胱甘肽过氧化物酶、谷胱甘肽还原酶、谷胱甘肽S-转移酶、γ-谷氨酰转移酶、过氧化氢酶、超氧化物歧化酶和葡萄糖-6-磷酸脱氢酶的活性,从而支持了草甘膦除草剂(GSH)水平的下调。
草甘膦已被描述为一种影响男性生殖系统的内分泌干扰物。然而,其毒性的分子基础尚待阐明。我们提议,草甘膦除草剂农达毒性,涉及Ca(2+)超载、细胞信号失调、内质网的应激反应和/或耗尽的抗氧化剂防御,可能会导致精子发生中的支持细胞分裂,可能对男性生育力产生影响。
Cavalli, V.L.D.L.O.et al.,Roundup disrupts male reproductive functions by triggering calcium-mediated cell death in rat testis and Sertoli cells.
Free.Radic. Biol. Med. Dec 2013, 65, 335–346.
Cavalli, V.L.D.L.O.et al.,草甘膦除草剂农达通过触发大鼠睾丸和睾丸支持细胞中钙介导的细胞死亡破坏雄性生殖功能。自由基生物学和医学,2013年12月;65, 335–346.
https://pubmed.ncbi.nlm.nih.gov/23820267/
11、世界卫生组织国际癌症研究机构(IARC)2015年3月确认:“在美国,加拿大,和瑞典的职业接触病例对照研究中,非霍奇金淋巴瘤的风险增加”、“在雄性CD-1小鼠中,草甘膦在一种罕见的肿瘤肾小管癌的发病率中引起了阳性趋势。第二项研究报道了雄性小鼠血管肉瘤的阳性趋势。在两项研究中,草甘膦增加了雄性大鼠的胰岛细胞腺瘤。草甘膦制剂在小鼠的启动促进研究中促进了皮肤肿瘤”、“草甘膦和草甘膦制剂在哺乳动物以及人和动物细胞中体外诱导DNA和染色体损伤”、“草甘膦、草甘膦制剂和AMPA会在啮齿动物和体外引起氧化应激”、“将草甘膦归类为“可能对人类致癌”(2A组)”。
证据11(2015年3月):《柳叶刀-肿瘤学》(Lancet. Oncol. )发表世界卫生组织国际癌症研究机构(IARC)Guyton, K.Z. et al.《四氯乙烯磷、对硫磷、马拉硫磷、二嗪农和草甘膦的致癌性》确认: 2015年3月,来自11个国家/地区的17位专家在国际癌症研究机构(IARC;法国里昂)会面,评估了有机磷酸酯农药四氯乙烯磷、对硫磷、马拉硫磷、二嗪农和草甘膦的致癌性(表)。 这些评估将作为IARC专着的第112卷出版[1]。
草甘膦是一种广谱除草剂,是目前在所有除草剂中产量最高的除草剂。 它被用于农业、林业、城市和家庭应用的750多种不同产品中。 随着抗草甘膦转基因作物品种的发展,其使用量急剧增加。 草甘膦已在喷雾,空气和食物中被检测到。
在人类中草甘膦的致癌性的证据有限。 在美国[14],加拿大[6],和瑞典[7]的职业接触病例对照研究中,非霍奇金淋巴瘤的风险增加,但在调整其他农药后仍然存在。 美国农业健康研究(AHS)队列未显示出非霍奇金淋巴瘤的风险显着增加。
在雄性CD-1小鼠中,草甘膦在一种罕见的肿瘤肾小管癌的发病率中引起了阳性趋势。第二项研究报道了雄性小鼠血管肉瘤的阳性趋势[15]。在两项研究中,草甘膦增加了雄性大鼠的胰岛细胞腺瘤。草甘膦制剂在小鼠的启动促进研究中促进了皮肤肿瘤。在农业工人的血液和尿液中检测到草甘膦,表明吸收了草甘膦。
土壤微生物将草甘膦降解为氨基甲基磷酸(AMPA)。中毒后的血液AMPA检测表明人体中的肠道微生物代谢。草甘膦和草甘膦制剂在哺乳动物以及人和动物细胞中体外诱导DNA和染色体损伤。一项研究报告说,在喷洒草甘膦制剂后,多个社区居民的染色体损伤(微核)血液标志物增加[16]。细菌诱变试验为阴性。草甘膦、草甘膦制剂和AMPA会在啮齿动物和体外引起氧化应激。
工作组将草甘膦归类为“可能对人类致癌”(2A组)。
Guyton, K.Z.et al.,Carcinogenicity of tetrachlorvinphos, parathion, malathion, diazinon, andglyphosate. Lancet. Oncol. 2015, 16, 490–491.
Guyton, K.Z. et al.,四氯乙烯磷、对硫磷、马拉硫磷、二嗪农和草甘膦的致癌性。
https://www.sciencedirect.com/science/article/abs/pii/S1470204515701348
12、法国科学家塞拉里尼团队2015年10月研究揭示:草甘膦除草剂对人类健康的危害,是草甘膦除草剂配方所有成分与污染物协同造成的危害,不是单独单一成分草甘膦造成的危害。草甘膦产业与监管机构故意忽略草甘膦除草剂中表面活性剂佐剂与致癌污染物甲醛的作用,仅对单一成分草甘膦进行毒理学研究,从来没有在监管机构允许的“可接受每日摄入量“(ADI)或更低剂量水平进行毒理学研究。草甘膦是金属阳离子强螯合剂,还充当质子体增加线粒体膜对质子和Ca2 +的渗透性;草甘膦具有内分泌干扰剂作用,在远低于监管机构允许的“可接受每日摄入量“(ADI)的低微量甚至超低微量通过内分泌干扰、氧化应激和细胞损伤,致肝肾毒性、慢性毒性/致癌性。该项研究最后呼吁:“我们呼吁对农达除草剂和其他草甘膦除草剂进行公开、独立、透明、多学科的评估”。
证据12(2015年10月):《食物化学毒理学》(Food. Chem. Toxicol.)发表法国卡昂大学生物与风险、质量和可持续环境网络研究所、基因工程独立研究和信息委员会(CRIIGEN)法国科学家塞拉里尼团队《低于监管限制草甘膦及其商业制剂的潜在毒性作用》确认: 要点:
-- 我们审查了草甘膦及其商业制剂的毒性作用。
-- 草甘膦除草剂引起致畸,致瘤和肝肾影响。
-- 这些影响可以通过内分泌干扰和氧化应激来解释。
-- 在监管机构建议的“每日可接受摄入量”范围内检测到一些影响。
-- 目前提供的证据引起了人们的关注,表明进一步研究的必要。
草甘膦除草剂(GlyBH),包括农达(Roundup),是全球使用最广泛的农药。自从投放市场以来,它们的用途呈指数增长。食物或水中的残留物水平以及人体暴露水平正在不断提高。
我们通过评估已发表的文献和法规报告,审查了在低于法规限制的范围内测得的草甘膦除草剂(GlyBH)的毒性作用。我们揭示了连贯的证据,表明草甘膦除草剂(GlyBH)在低于法规规定的“观察到慢性毒性不良反应的最低水平”有毒性。它包括致畸、致瘤和肝肾影响。可以通过内分泌干扰和氧化应激来解释,取决于剂量和暴露时间,引起代谢改变。
某些影响在建议监管机构规定的“每日可接受摄入量”(ADI)范围内检测到。商业制剂的毒性作用也可以用草甘膦除草剂(GlyBH)佐剂来解释,佐剂具有自身的毒性,但也能增强草甘膦的毒性。
这些挑战质疑了草甘膦除草剂(GlyBH)在其污染食物和环境的水平下的安全性假设,尽管这些水平可能会低于监管阈值。必须重新研究草甘膦除草剂(GlyBH)的神经发育、生殖和转基因作用,因为越来越多的知识表明,与环境有关的接触水平导致内分泌干扰机制的优势。
草甘膦还是金属阳离子(例如铜、锰、钴、铁和锌)以及钙和镁的强螯合剂(Lundager Madsen et al., 1978),并最初为此功能申请了专利(U.S. Patent No. 3,160,632, 1964)。糖基酸的螯合剂的作用也部分解释了它对线粒体链的解偶联作用(Olorunsogo, 1990)。
此外,草甘膦充当质子体(Olorunsogo, 1990),增加了线粒体膜对质子和Ca2 +的渗透性这一事实,也可以解释单独使用草甘膦(Astiz等,2009a)或其制剂(El-Shenawy, 2009),并从体外实验中了解了分子作用(Gehin等人,2006年)。
肝肾毒性评论
有连贯的证据表明草甘膦及其商业除草剂制剂会引起氧化应激,从而导致器官损害。由于形成促氧化环境的因素与细胞抗氧化剂防御系统之间的不平衡而产生氧化应激(Zhu et al., 2012)。活性氧是高活性分子,可能会破坏脂质,蛋白质或DNA等细胞分子。过多的氧自由基会导致细胞损伤(Zhu et al., 2012)。此类破坏可以通过碱性磷酸酶(AP)或天冬氨酸转氨酶(ASAT)和丙氨酸转氨酶(ALAT)活性增加反映出来(Yamada et al., 2006)。
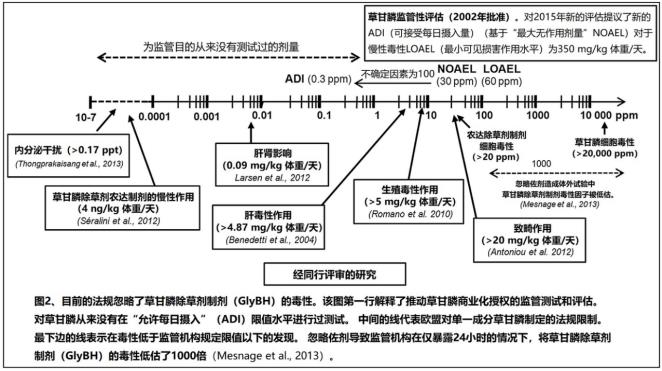
尽管新的草甘膦毒性作用的法规评估确定NOAEL和LOAEL的慢性毒性作用分别为100和350 mg / kg bw / d,但同一机构先前的评估(德国联邦机构CPFS,1998)认为将最大无作用剂量(NOAEL)和最小可见损害作用水平(LOAEL)分别设为30和60 mg / kg 体重/天。它们被用来计算ADI的0.3 mg / kg 体重/天。
实际上,在所有研究中,都有一个连贯的模式显示出对肝脏的毒性作用(以AP活性增强为标志)。 从10 mg / kg体重/天开始可以观察到趋势,根据研究,在不同剂量下达到统计学显着性。
实际上,不同监管研究的结果是高度异类的。 一些研究从100 mg / kg 体重/天的剂量中发现了急性中毒的迹象,而另一些研究在更高剂量时没有报告不良反应。 这些差异可能是由被测物质的不同污染引起的。
孟山都公司进行的草甘膦滤液中检测到了污染物
实际上,在孟山都公司(Smith and Barclay, 1992)进行的草甘膦滤液中检测到了污染物,例如膦酰基甲基亚氨基二乙酸(100 ppm),N-甲酰基草甘膦(100 ppm),羟甲基膦酸(20 ppm),磷酸盐( 200 ppm),亚磷酸酯(40 ppm),亚氨基-双-亚甲基膦酸(350 ppm),草甘膦酸甲酯(600 ppm),甲酸(1.50%),草甘膦代谢物AMPA(3500 ppm)和甲醛(2.85%)。
啮齿动物实验室饲料也是污染源
此外,啮齿动物实验室饲料也是污染源。 饲料污染物的毒性水平存在可能掩盖被测物质的毒性作用(Mesnage et al., 2015)。 实际上,由于潜在的饲料污染物引起的病理学背景发生率,有必要使用大量动物来检测慢性毒性试验中的统计学差异,因为某些动物在试验结束前就因慢性疾病而死亡。
低微量草甘膦或其除草剂商业制剂毒理学试验
在同行评审的文献中报告的毒性作用的水平较低,从草甘膦除草剂商业制剂中稀释到水中可产生长期影响的毒性水平为0.1 ppb,而单一成分草甘膦亚慢性暴露的毒性水平为0.09 mg / kg 体重/天。通常,很少有研究在与环境相关实际水平上研究慢性毒性作用。一项农场研究证实了实验动物对肝脏的影响及其在细胞培养模型系统中的作用机制,该研究在牛中测得的肝功能障碍标志物(谷氨酸脱氢酶、谷氨酸草酰乙酸转氨酶和肌酸九激酶)与其尿液中的草甘膦水平有统计学相关性(Krüger et al., 2013)。
总体而言,在同行评审的文献中,至少有12项研究报道了草甘膦或其除草剂商业制剂的毒性作用水平低于对慢性毒性作用的法定最小可见损害作用水平(LOAEL)(表1)。这些研究的大多数不是长期研究,并且持续时间短。有三项研究甚至报告了在低于环境允许摄入量水平造成的肝肾变化,其水平与环境暴露有关(Larsen et al., 2014, 2012; Seralini et al., 2014a)。但是,它们的药理学相关性需要通过重复这样的研究来确定。
8.一般性讨论和结论性意见
8.1 佐剂、污染物或代谢产物也可以解释毒性:草甘膦的不同作用
在各种哺乳动物体内(Adam et al., 1997; Peixoto, 2005)和其他物种体内(Folmar et al., 1979; Frontera et al., 2011; Moore et al., 2012; Tsui and Chu, 2003)进行的几乎所有同行评审研究中,均观察到了农达除草剂制剂和草甘膦毒性之间的差异作用(表1和2)。
与所谓的“活性成分草甘膦”相比,整个除草剂制剂的毒性增加明显与佐剂有关。这些佐剂本身可能有毒,或促进环境污染物更好地吸收除草剂成分,因此增加了暴露生物的身体负担。
农药生产商赞助的评论也强调了这一点(Williams et al., 2012)。佐剂的毒性表现为农药毒理学的一般特征,在全球主要除草剂的主要模型草甘膦除草剂(GlyBH)中特别明显,但对其他农药也有这样的描述(Eddleston et al., 2012)。在用于杀虫剂、杀真菌剂或除草剂的9种主要已宣布有效成分中,有8种的毒性比其在体外对人体细胞的制剂的毒性低1000倍,而与一般的看法相反,草甘膦除草剂农达(Roundup)是在配方中进行了测试的除草剂和杀虫剂中毒性最高的(Mesnage et al., 2014)。
我们在表3中总结了草甘膦除草剂(GlyBH)主要已知佐剂的毒性作用。不同配方的佐剂中的成分似乎变化很大(表3)。首先,似乎大多数都没有经过完全测试;通常缺乏慢性毒性测试以及有关神经发育、生殖和跨代影响的信息。
实际上,在这项研究中确定的佐剂或污染物的毒性是高度可变的。 有些相对安全(例如山梨酸、壬酸或甘油),而另一些则是剧毒的(乙氧基化佐剂),甚至被认为具有致癌性(对羟基苯甲酸甲酯、邻苯二甲酸钠、1,4-二恶烷或甲醛)和可能本身就是内分泌干扰物。 但是,当将它们包含在农药制剂(惰性成分)中时,认为它们的毒理学分类都相同,但是同样物质在其他产品中被宣布为活性成分时,它们的毒理学分类则不同。
表面活性剂POEA
我们一直将表面活性剂POEA用作草甘膦除草剂(GlyBH)佐剂的模型,因为它是草甘膦除草剂配方中使用的主要表面活性剂之一。 表面活性剂POEA在三种不同的人类细胞系中的毒性看来比单一成分草甘膦高10,000倍,因此成为草甘膦除草剂的次要副作用的良好候选者(Mesnage et al., 2013)。
这一发现不能仅仅归因于与细胞培养有关的现象,因为在急性暴露下,表面活性剂POEA还会对人类和大鼠的健康造成严重后果(Adam et al., 1997; Bradberry et al., 2004)。 POEA毒性也已在其他模型中显示出来,例如在两栖动物、甲壳类动物、鱼类和细菌体内(Folmar et al., 1979; Mann and Bidwell, 1999; Mitchell et al., 1987; Tsui and Chu, 2003)。
当在自来水、食物或饲料中发现农药残留时,它们是从农药的总配方中产生的,而不是仅来自单一成分活性成分,它们永远不会单独使用。草甘膦除草剂中由于使用了大量的佐剂(也称为表面活性剂),因此可以在环境中发现(Berge et al., 2012)和食品中发现(Shao et al., 2007; She et al., 2012)。从农业地区的地下水和土壤间质水中也可以发现一些佐剂,如乙醇乙氧基化物(Krogh et al., 2002)。事实上,在水生环境中,表面活性剂POEA的半衰期(21-42天)甚至比草甘膦的半衰期更长(7-14天)(Giesy et al., 2000)。
单一制剂农药的接触必须被视为与活性成分和佐剂的共同接触。 对于佐剂毒性的知识对于仅对单一成分草甘膦做长期试验代替视草甘膦作为唯一的活性成分的毒理学评估方式提出了质疑。 还应对配制的农药进行监管测试,以更好地估计健康风险。 我们鼓励监管机构要求对草甘膦制剂(而不是单一成分草甘膦)特别是通过考虑与内分泌学和表观遗传学有关的原理,在环境相关剂量下通过对哺乳动物进行全寿命测试进行全面重新评估,而且充分考虑详细血液和尿液分析提出的原则(图1)。
8.2监管评估的有效性
在美国系统中,美国环保署(EPA)对每种注册农药每15年重新复查一次,以确定其是否继续符合《联邦杀虫剂,杀菌剂和灭鼠剂法》(FIFRA)的标准。草甘膦有望在2015年重新注册。目前,欧盟(EU)商业化委员会(2002)对草甘膦的批准是基于德国联邦机构的审查。下一次草甘膦审查原定于2012年进行,但被推迟了。德国(报告员成员国)发表了其结论(German Federal Agency BfR, 2014)。德国建议将草甘膦的“可接受每日摄入量“(ADI)从0.3 mg / kg 体重/天提高到0.5 mg / kg 体重/天,尽管自2002年批准以来已经发表了更多的毒性数据,这使人们对现有“可接受每日摄入量“(ADI)的安全性产生了怀疑(图2)。
低于350 mg / kg 体重/天的草甘膦剂量显然会影响肝和肾,这在上一份评估报告草案中被认为是整体“最小可见损害作用水平”(LOAEL)。在所审查的研究中,许多研究表明不同水平的碱性磷酸酶(AP)活动增加。总体而言,碱性磷酸酶(AP)活性通常从10 mg / kg bw / d增加,而在不同水平上均达到统计学显着性。
对原始数据保密的事实阻止了对慢性毒性研究结果的任何荟萃分析。在学术研究中,已发现从0.09 mg / kg 体重/天的单一成分草甘膦亚慢性暴露后在大鼠后中发现了氧化应激的生化迹象(Larsen et al., 2014, 2012)。长期暴露后,溶解了商业化的草甘膦除草剂(GlyBH)制剂0.1 ppb的饮用水损害了的肝和肾(Seralini et al., 2014a)。在监管性研究中,20 mg / kg 体重/天的剂量造成了内脏和骨骼畸形(Antoniou, 2012)。所有这些影响都可以通过对草甘膦的氧化磷酸化的解偶联作用以及对细胞色素P450或能量和代谢酶的抑制作用来解释,草甘膦会导致内分泌破坏、氧化应激和细胞损伤,以及可能的表观遗传学改变。
此外,监管机构尚未对我们所接触的草甘膦除草剂(GlyBH)的真实混合物和不同混合物进行科学评估。佐剂(例如表面活性剂POEA)通过增加细胞内草甘膦的吸收或通过破坏细胞膜增加其自身的毒性来放大毒性。如前所述,根据体外和体内对佐剂和其他污染物的特异性扩增作用,可以将另一种安全“混合物”因子应用于草甘膦除草剂(GlyBH)。动物一生中每天摄入1mg / kg至10 mg / kg 体重每天5000 mg / kg 体重甚至10,000 mg / kg 体重的剂量造成的影响,不能用来结论每天暴露10-100 mg / kg体重范围的影响。
对与农达除草剂和单一成分草甘膦的毒性二者主要终点,例如对成人的发育、生殖、转基因乃至慢性影响,仍需要以相关剂量进行研究,因为在这种剂量下可能会产生内分泌干扰作用。缺乏对低剂量慢性影响的研究以及对非单调剂量反应关系的忽视,使得低于50 mg / kg 体重/天的草甘膦的安全性结论令人怀疑。第一个也是最小的评估方法是在哺乳动物的整个生命中(包括产前暴露)测试草甘膦“可接受每日摄入量”(ADI)剂量下的慢性毒性/致癌性。
图2、目前的法规忽略了草甘膦除草剂制剂(GlyBH)的毒性。该图第一行解释了推动草甘膦商业化授权的监管测试和评估。对草甘膦从未在“允许每日摄入”(ADI)限值水平进行过测试。 中间的线代表欧盟对单一成分草甘膦制定的法规限制。最下边的线表示在毒性低于监管机构规定限值以下的发现。 忽略佐剂导致监管机构在仅暴露24小时的情况下,将草甘膦除草剂制剂(GlyBH)的毒性低估了1000倍(Mesnage et al., 2013)。
在等待对草甘膦除草剂制剂(包括农达除草剂Roundup)进行进一步的强制性和独立的长期评估之前,在制定保护公共卫生的政策时应牢记完整配方制剂与单一成分草甘膦毒性方面的巨大差异。总体而言,在目前的监管评估中,首先会偶然地将任何毒性作用怀疑为假阳性,而不是质疑是否没有证据表明是假阴性结果。考虑到当前评估中存在漏洞,我们鼓励监管者要求对草甘膦制剂进行全面的重新评估,而不是仅对单一成分草甘膦进行重新评估。
8.3 在环境水平上的毒性
长期摄入量的估算是在“国家评估的每日摄入量”(NEDI)的基础上,根据草甘膦的“监督试验中值残留”(STMR)计算得出的,该水平被认为是食品中农药的实际含量。
在所有国家/地区中,丹麦计算得出的草甘膦“国家评估的每日摄入量”(NEDI)最高,为0.0125 mg / kg体重。 根据德国的估算,普通人群(14至80岁)的“国家评估的每日摄入量”(NEDI)为0.0073 mg / kg 体重。 根据使用小样本研究的有限研究,估计在尿液中经常发现草甘膦,其水平相当于每天的饮食摄入量约为0.1 - 3.3 mg / kg 体重/天(Niemann et al., 2015)。
综上所述,在低于监管限制水平且与环境暴露相关的条件下进行的研究最多表明了草甘膦的潜力 - 更重要的是,含草甘膦的除草剂商业配方- 长期引起低水平内分泌相关有害影响。 在这一阶段,尚不清楚这是由于草甘膦、制剂成分还是两者兼而有之。
在这些阶段尚无法从这些研究中得出任何肯定的结论,还需要进一步的工作来确定除草剂本身或制剂中的安全性或风险,尤其是在低于规定的安全限值且持续时间较长的情况下。 然而,草甘膦从未在体内单独使用,在许多研究中,已证明草甘膦除草剂(GlyBH)制剂在低于调节极限的多个细胞和体内试验终点均具有毒性。 据监管机构称,并非仅草甘膦如此。
通过适当的研究设计,应该有可能将仅由于草甘膦、仅由于制剂的组成部分或二者协同造成的影响分开。 以上提供的当前证据引起了人们的关注,并表明需要进一步研究。 我们呼吁对农达除草剂(Roundup)和其他草甘膦除草剂(GlyBH)进行公开、独立、透明、多学科的评估。
Mesnage, R., Seralini, G.E.et al.,Potential toxic effects of glyphosate and its commercial formulations below regulatory limits. Food. Chem. Toxicol. Oct 2015, 84, 133–153.
Mesnage, R., Seralini, G.E.et al.,低于监管限制草甘膦及其商业制剂的潜在毒性作用。食物化学毒理学。2015年10月;84, 133–153.
https://www.sciencedirect.com/science/article/abs/pii/S027869151530034X
13、孟山都公司草甘膦除草剂农达制剂1988年申请“农药登记”提交的毒理学动物试验报告白纸黑字声称“草甘膦除草剂‘农达’...‘三致’试验结果表明该产品无致癌”!
证据13(1988年):农业部2014年7月28日《农业部信息公开申请答复书》【农公开(农)[2014]12号】确认: 农公开(农)[2014] 12号
杨晓陆、李香珍:
你们于2014年7月8日提交的关于孟山都草甘勝除草剂“农 达”毒理、残留及环境影响等政府信息公开申请收悉。现答复 如下。
2014年6月4日,我部农公开(农)[2014] 8号文已就草甘麟 除草剂“农达”毒理学试验报告信息公开事宜答复你们,不再重复 答复。现将毒理学试验结果和残留、环境质量影响有关信息函告 如下。 '
(一)毒理学试验结果:原药急性经口毒性为低毒;亚慢性及 慢性毒性试验结果表明,该产品毒性较低;代谢试验表明草甘滕在 体内无蓄积性,能较快地从体内排出;“三致”试验结果表明该产品无致癌、致突变和致畸性;每人每天允许摄入量0. lmg/kg bw0 “农达”制剂急性毒性为微毒,对家兔眼睛和皮肤无刺激性、无致 敏性。
(二) 农达“残留在作物及其产品中的残留、代谢、降解和分析 方法”:该产品残留检测方法采用气相色谱-火焰光度计检测器 法,柑橘中的检出限为0.3mg/kg,登记作物柑橘果肉中的残留量< 0. 3mg/kgo
(三) 农达“环境质量影响对大气、水、土壤、植物和生态系统 的污染和影响”:在土壤中易降解,对光稳定,对鱼、潢、鸟类和水生 生物低毒,在生物体内易排出,无积蓄现象。
(农业部信息公开申请答复专用章)
2014年7月28日
农业部2014年7月28日《信息公开申请答复书》【农公开(农)[2014]12号】扫描件
14、农业部《转基因权威关注》2011年9月转载《关于大豆中草甘膦残留限量标准情况》到现在持续9年坚持不懈竭力宣扬:“在试验条件下对动物未见致畸、致突变、致癌作用。”
证据14(2011年9月):农业部《转基因权威关注》转载东北农业大学陶波《关于大豆中草甘膦残留限量标准情况》宣扬: (1)毒理学情况
按我国农药毒性分级,草甘膦原药为低毒。其大鼠急性经口LD50>5000(mg/kg),大鼠急性经皮LD50>2000 mg/kg,羊LD50>3530 mg/kg,兔急性经皮LD50>5000 mg/kg,大鼠急性吸入LD50(半致死浓度)>4.43 mg/L(4小时鼻暴露),对兔皮肤无刺激、眼睛有刺激。大鼠2年慢性喂养试验最大无作用剂量100 mg/kg(体重)/天。草甘膦对水生生物毒性较低,对蜜蜂和鸟类无毒害,对天敌及有益生物较安全。在试验剂量范围内,未见对试验动物有蓄积毒性、致突变、致畸、致癌作用。
......可见,草甘膦作为一种世界范围内广泛使用的除草剂,其毒性是非常低的,就鼠的经口毒性来说,比食盐的还要低。相关研究表明:草甘膦在动物体内不蓄积。在试验条件下对动物未见致畸、致突变、致癌作用。对鱼和水生生物毒性较低;对蜜蜂和鸟类无毒害;对天敌及有益生物较安全。
...
1、中国:现已制定了草甘膦11项残留限量标准(mg/kg),分别为稻谷0.1、小麦5、小麦粉0.5、全麦粉5、玉米1、水果0.1、甘蔗2、棉籽油0.05、茶叶1、柑橘0.5、苹果0.5。
... 由于我国没有推广抗草甘膦转基因大豆,同时草甘膦也不能在大豆田应用,因此目前尚未制定草甘膦在大豆中的限量标准。
五、草甘膦使用范围的扩大
... 保护性喷雾在玉米、高粱、大豆等作物株高25~30cm以上时,在喷雾器上安装保护罩进行喷雾,使药液雾滴不接触作物,而喷于杂草植株上。此外,这种喷雾方法也可用来防治稻田田埂杂草。甘蔗增糖:在甘蔗收割前10~15d ,喷洒低剂量草甘膦。
作物干燥与催熟:主要用于小麦、玉米、大豆与棉花等作物,通常在收获期前10~15d左右喷药,小麦、玉米用量0.25~0.85 kg/hm2,棉花用量0.85~4.0kg/hm2。在我国东北地区,由于生育期短,作物收获时籽粒含水量高,出现所谓“水苞米”现象,喷洒草甘膦将有助于解决这一问题。
陶波,关于大豆中草甘膦残留限量标准情况,农业部《转基因权威关注》,2011-09-19
http://www.moa.gov.cn/ztzl/zjyqwgz/zxjz/201109/t20110919_2290532.htm
15、拜尔公司收购孟山都公司后,草甘膦除草剂2018年向农业部申请续延“农药登记”时,依然谎称“微毒”!
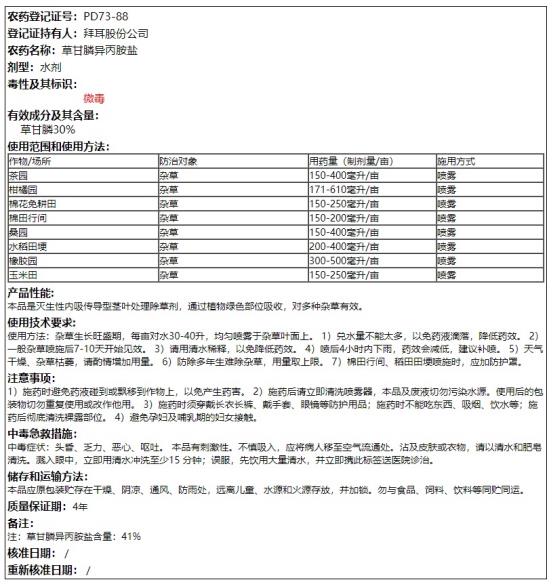
证据15(2018年):《拜尔公司草甘膦异丙胺盐农药登记(PD73-88)》(有效期至:2023-04-15)标签注明:“微毒”! 农药登记证号:PD73-88
登记证持有人:拜尔股份公司
农药名称:草甘膦异丙胺盐
毒性及其标识:微毒
适用范围及施用方法:茶园、柑橘园、棉花免耕田、棉田行间、桑园、水稻田埂、橡胶园、玉米田(喷雾)。”
中华人民共和国农业农村部农药检定所《中国农药信息网》“农药登记”检索系统(截屏)
http://www.chinapesticide.org.cn/myquery/tagdetail?pdno=PD73-88